La adicción farmacológica de los tumores
A medida que las células cancerosas se vuelven resistentes a los medicamentos que se dirigen a las vías de la señalización específicas del cáncer, a veces se desarrolla un fenómeno intrigante conocido como adicción celular a las drogas. Esto ocurre cuando las células que son resistentes al tratamiento farmacológico pasan a generar una dependencia de la droga. Recientes estudios proporcionan información valiosa sobre los mecanismos subyacentes a este tipo de adicción en el cáncer. Sus conclusiones tienen implicaciones importantes para el uso de terapias dirigidas a tumores.
Células cancerosas adictas
Un reciente estudio elaborado por Xiangjun Kong y colegas (Nature. 2017 Oct 12;550(7675):270-274)examinó muestras de células de melanoma cultivadas in vitro. Las trataron con el medicamento dabrafenib, dirigido a la proteína BRAF en cánceres que tienen una mutación en el gen BRAF. Alternativamen te, también trataron las células con dabrafenib y trametinib, que apunta a una enzima de la vía de BRAF llamada MEK. Se identificaron células drogadictas, que morían si no recibían tratamiento farmacológico.
Los autores estudiaron muestras de células de cultivo de melanoma. Las trataron con el medicamento dabrafenib, dirigido a la proteína BRAF en cánceres que tienen una mutación en el gen BRAF. Alternativamen te, también trataron las células con dabrafenib y trametinib, que apunta a una enzima de la vía de BRAF llamada MEK. Se identificaron células drogadictas, que morían si no recibían tratamiento farmacológico.
Para encontrar el mecanismo responsable de la adicción farmacológica bajo este contexto, Kong y colegas usaron una técnica de ingeniería genética para eliminar genes en las células. Retiraron dabrafenib de las células modificadas, y analizaron los genes de células sobrevivientes cuya eliminación génica evitó la muerte o el arresto del crecimiento celular que normalmente ocurre en un caso de adicción celular cuando el medicamento es retirado. Estos experimentos permitieron a los autores identificar dos genes involucrados en el proceso de drogadicción.
Los genes codifican las proteínas ERK2 y JUNB, que desempeñan roles en la señalización celular mediada por BRAF. Entonces, usando un panel de líneas celulares resistentes a medicamentos y experimentos in vitro e in vivo, Kong y colegas demostraron que la deleción génica de MAPK1 (que codifica ERK2), JUNB o FOSL (que codifica la proteína de unión a JUNB, FRA1) bloqueaban la muerte de las células adictas.
Los autores descubrieron una exquisita especificidad de acción de las proteínas implicadas. Por ejemplo, la deleción de ERK2 previno la muerte celular asociada con la adicción, pero el agotamiento de ERK1 no tuvo ningún efecto en este proceso. Esto es consistente con la observación que cuando la droga es retirada, ERK2 pero no ERK1 se encuentra hiperactivada, aunque ambos actúan en el misma vía de señalización.
La vía de la adicción a las drogas era la misma independientemente de cómo la resistencia se desarrollaba en una célula particular. Por lo tanto, los hallazgos podrían tener relevanciapara el tratamiento de muchas personas que tienen melanoma farmacorresistente.
Para determinar cómo morían las células adictas cuando se retira la droga, los autores secuenciaron el ARN en este tipo de célula moribunda. A medida que las células morían, la expresión de genes asociados con la proliferación celular disminuyó, mientras que hubo una mayor expresión de genes asociados con metástasis. Este hallazgo relaciona la adicción a las drogas con el cambio fenotípico, una habilidad de las células del melanoma para cambiar entre un estado proliferativo y un estado invasor estado celular asociado con metástasis. El cambio fenotípico subyace en la plasticidad de las células del melanoma y su capacidad para adaptarse a su microambiente. El estado celular de las células del melanoma puede ser identificado monitoreando la expresión de la proteína E-cadherina u otras proteínas que son características de un cambio -conocido como la transición epitelio mesénquima TEM que ocurre cuando las células epiteliales se convierten en células mesenquimales. El cambio fenotípico resulta en un estado celular en el que las células tienen una probabilidad mayor de convertirse en metastásicas, y el cambio de TEM es parte del proceso que permite a las células hacer metástasis. La TEM está regulada en el melanoma por el factor de transcripción MITF, que es el regulador maestro del linaje del melanocito del que surge el melanoma.
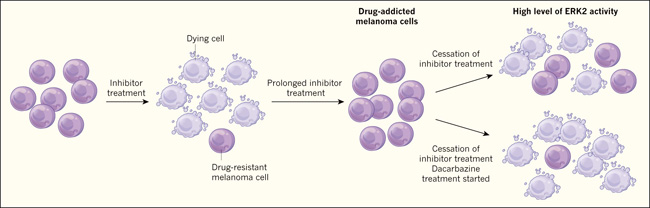
Figura 1. Adicción en células cancerosas.
Kong y colaboradores investigaron cómo el melanoma responde al tratamiento farmacológico usando células crecidas in vitro. Cuando las células son tratadas con moléculas inhibidoras que se dirigen a las proteínas BRAF o MEK, la mayoría mueren, aunque algunas podrían ser resistentes al tratamiento y sobrevivir. Si las células resistentes son tratadas con el inhibidor por un período prolongado, puede ocurrir un fenómeno de adicción, en la cual las células se vuelven dependientes de la droga y algunas podrían depender de su presencia para sobrevivir. Los autores identificaron varias proteínas involucradas en la vía de adicción, incluyendo la proteína ERK2. Observaron niveles elevados de activación de ERK2 cuando se retiraba el tratamiento de las células adictas, causando muerte celular, la que además podría incrementarse si el tratamiento con el agente quimioterapéutico dacarbazina era reiniciado al mismo tiempo que el inhibidor cesaba.
Los bajos niveles de MITF están asociados con un estado metastásico invasivo, mientras que los niveles altos están relacionados con la proliferación. Los autores encontraron que, en células adictas que contienen altos niveles de MITF, éstos fracasan en eliminar fármacos y las células adoptan una forma invasiva. Cuando los investigadores usaron ingeniería genética para prevenir una disminución en MITF cuando la droga era removida, la muerte celular asociada con la retirada de la droga se redujo. Sin embargo, el papel de MITF en este proceso de muerte celular aún es incierto, dado que se desconoce que los niveles bajos de expresión de MITF causen muerte celular.
El trabajo de Kong y sus colegas tiene efectos clínicos de relevancia cuando el tratamiento farmacológico se detiene; identificaron una ventana durante la cual el tratamiento de las células del melanoma crecidas in vitro con el agente quimioterapéutico dacarbazina podría aumentar la muerte celular (figura 1). Los autores proponen que se detenga el uso de inhibidores BRAF y MEK, y comenzar a utilizar dacarbazina, lo que sería más efectivo que simplemente detener todos los tratamientos con drogas en lo que denominan enfoques de "vacaciones para adictos" y que tienen como objetivo promover la muerte celular mediante el uso de drogas que generan adicción.
El momento del tratamiento farmacológico sería crucial. Los inhibidores MEK, en particular, tienen vidas medias extremadamente largas (hasta 10 días) y, dado que bajos niveles de inhibición de esta vía podrían prevenir la muerte celular causada por la adicción, la administración de drogas correctamente sincronizada sería esencial para lograr un beneficio óptimo. Existe evidencia clínica de que el re tratamiento con la terapia dirigida puede ser eficaz después de un receso de medicamentos implementado como resultado del progreso de la enfermedad o toxicidad. El cambio fenotípico cambio de proliferativo a invasivo puede reajustar la sensibilidad de las células a terapias focalizadas, aunque esto necesita ser investigado.
El emocionante trabajo reportado consiste principalmente en estudios in vitro, por lo que se requerirán estudios in vivo para examinar si el microambiente tumoral afecta a la adicción farmacológica. Su estudio también despierta muchas preguntas: por ejemplo, ¿por qué ERK2 pero no ERK1 media adicción, incluso aunque ambos son componentes clave de la vía MAPK? Una red compleja de retroalimentación regulan esta vía, y el el papel de estos mecanismos reguladores en la adicción celular debería ser investigado.
La clave para trasladar estos hallazgos en usos clínicos determinará si otras drogas funcionan mejor que la dacarbazina si se usan de forma combinada con la abstinencia de drogas para atacar células adictas. También sería útil investigar el mecanismo que subyace a este tipo de sinergia con mayor detalle. Las mejoras en la comprensión de la adicción celular que viene de este último trabajo claramente ofrece un prometedor comienzo para explorar oportunidades terapéuticas que podrían surgir de este talón de Aquiles del cáncer.
Fuente bibliográfica
Cancer: Tumours addicted to drugs are vulnerable.
Rebecca J. Lee & Richard Marais
Molecular Oncology Group, Cancer Research UK Manchester Institute, Manchester.
doi: 10.1038/nature24148