Nanopartículas para combatir la autoinmunidad
Las células T reguladoras representan una prometedora diana terapéutica en casos de trastornos relacionados al sistema inmunológico. Recientes estudios, han mostrado que la administración de nanopartículas recubiertas con fragmentos de proteínas propias del organismo y vinculadas a patologías autoinmunes, conduce a una regulación sistémica de la respuesta de autodefensa. Este complejo molecular, utilizado en ratones con linfocitos de pacientes que sufren estos trastornos, permite atenuar la respuesta inmunológica contra antígenos propios, mediante una diferenciación de linfocitos de perfil Th1 hacia células T reguladoras (células tipo Tr1). Por otro lado, esta regulación impide a células presentadoras de antígeno poder activar a linfocitos T citotóxicos y colaboradores. Interesantemente para los avances de la medicina, las células tipo Tr1 además pueden dirigirse a tejidos dañados e inhibir respuestas proinflamatorias perjudiciales para el organismo, lo que representa un prometedor camino para controlar este tipo de trastornos.
Inmunoterapia antígeno específica
Las enfermedades autoinmunes surgen cuando el sistema inmunitario ataca a los tejidos propios. En estos casos, las células de defensa no son lo suficientemente tolerantes frente a determinadas proteínas propias y reaccionan contra éstas como si fueran extrañas. Las células T colaboradoras (células Th) desempeñan un papel central en enfermedades autoinmunes porque orquestan la función de otras células del sistema inmunitario, incluyendo células B, linfocitos T citotóxicos y macrófagos. Los tratamientos convencionales para trastornos autoinmunes tienden a suprimir la totalidad del sistema, o en el mejor de los casos, inhiben el movimiento o función de las células T. Tales enfoques, inevitablemente aumentan el riesgo de infecciones y de cáncer. La terapia ideal para las patologías de este tipo debería ser capaz de revertir la actividad anómala de linfocitos Th hacia una función reguladora, sin afectar al resto del sistema inmunológico. Recientemente, en un estudio publicado por Xavier Clemente-Cáceres y colaboradores (Nature. 2016 Feb 25;530(7591):434-40) se describe cómo nanopartículas recubiertas median esta conversión a través de la unión a receptores presentes en linfocitos T potencialmente autorreactivos.
El enfoque de los autores puede ser considerado como un tipo de inmunoterapia específica de antígeno. Los antígenos son las estructuras moleculares que inducen la activación de células T o B. Para las células T estos son generalmente pequeños fragmentos de proteínas (péptidos). Cada linfocito T puede expresar un receptor de superficie diferente, permitiendo así que el sistema de defensa sea capaz de responder a un sin número de antígenos, incluyendo los propios. La inmunoterapia antígeno-específica está diseñada para reducir la respuesta inmunitaria frente a un antígeno particular o un conjunto de antígenos estrechamente relacionados. Este concepto se ha utilizado por más de un siglo para tratar alergias, pero la inmunoterapia específica para enfermedades autoinmunes no progresó hasta el descubrimiento de que las células Th eran activadas mediante péptidos unidos a proteínas del MHC de clase II. Esto condujo al diseño de péptidos que se dirigen selectivamente a linfocitos Th, sin el riesgo de activación de células B o T citotóxicas autorreactivas.
De todo lo anterior surge la siguiente interrogante: ¿cómo se logra evitar la autoinmunidad mediante la exposición a un péptido propio? Esto se explica mejor por la regla de "dos señales" de la activación de linfocitos T. Todos los antígenos, ya sean propio o extraños, deben estar desglosados como péptidos, los que deben unirse a las proteínas del MHC de clase II y exhibirse en la superficie de células presentadoras de antígenos (APC, por sus siglas en inglés) para activar a linfocitos Th. Esto se conoce como señal 1. Las APC también sobrerregulan moléculas coestimuladoras, tales como CD80 y CD86, para proporcionar una segunda señal, necesaria para la supervivencia y proliferación de células Th1.
Por otro lado, ¿qué ocurre cuando las células Th reciben la señal 1, pero no la señal 2? Históricamente, se pensaba que esto inducía a un estado de carencia de respuesta, conocido como anergia. Recientemente, Clemente-Casares y colegas demostraron que el tratamiento de células Th con nanopartículas revestidas con un péptido unido a MHC de clase II (tratamiento pMHC-NP) gatilla solamente señales tipo 1. Pero en lugar de simplemente inducir anergia, el tratamiento conduce a los linfocitos Th a diferenciarse en células con características reguladoras, las que ejercen una función amortiguadora de la respuestas.
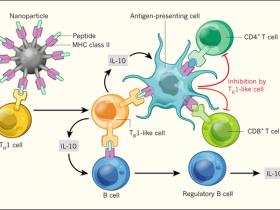
Las células reguladoras resultantes ejercen su función mediante la secreción de las proteínas anti-inflamatorias IL-10 y TGF-β. Además, expresan el factor de transcripción T-bet, produciendo la citoquina IFN-γ durante su diferenciación. Estas propiedades, implican que se derivan de células con perfiles de respuesta del tipo Th1 (fig. 1). La diferenciación de linfocitos T secretores de IL-10 (denominadas como células tipo Tr1) a partir de células Th1 es un mecanismo inmunorregulatorio conocido para prevenir respuestas exacerbadas frente a un rango de infecciones. Estas células median una retroalimentación negativa, que incluye la supresión de moléculas co-estimuladoras de las APC y una reducción de las proteínas inflamatorias secretadas por las mismas.
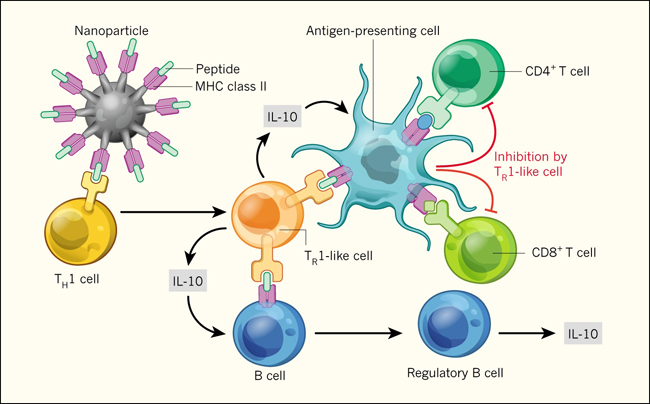
Figura 1. Nanopartículas recubiertas inducen la diferenciación de células T reguladoras.
Clemente-Casares y colegas, sintetizaron nanopartículas con fragmentos peptídicos de proteínas propias del organismo, relacionadas a enfermedaddes autoinmunes y a su vez unidos a proteínas del MHC de clase II. Los investigadores mostraron que el tratamiento de ratones, humanizados con linfocitos de pacientes que sufren complicaciones autoinmunes, modifica la función de células Th1, las que, a su vez cuentan con receptores específicos para ese péptido particular. De esta forma, en lugar de inducir una respuesta inmune contra las propias proteínas, las células Th1 se diferencian en linfocitos T reguladores (células tipo Tr1) los que secretan la proteína anti-inflamatoria IL-10. Esta citoquina, promueve la diferenciaciónde células B en linfocitos reguladores capaces de producir aún más IL-10 y también modifica la capacidad de células presentadoras de antígeno (APC) para exhibir el péptido específico a otras células de defensa. Además, las células Tr1 pueden suprimir la activación de linfocitos colaboradores (CD4 +) y citotóxicos (CD8 +), que poseen especificidad para otros péptidos presentados por las mismas APC, y por lo tanto median una supresión indirecta. De esta manera, las células Tr1- pueden dirigirse a las APCs en tejidos afectados por reacciones autoinmunes y de ese modo inhibir respuestas inflamatorias asociadas con enfermedades.
¿Cuáles son los efectos río abajo de las células tipo Tr1 inducidos por el tratamiento pMHC-NP? Los autores mostraron que las células suprimen la función de las APC y refuerzan la regulación inmune mediante la producción de IL-10 por las células B (fig. 1). También verificaron la especificidad de su enfoque mediante el uso de diferentes modelos experimentales de enfermedad autoinmune. El complejo pMHC-PN, que porta péptidos derivados de colágeno, un antígeno de las articulaciones, suprime la autoinmunidad en un modelo animal de artritis reumatoide, pero no en ratones con encefalitis autoinmune experimental (EAE), un modelo de esclerosis múltiple. Contrariamente, pMHC-PN al portar péptidos de antígenos del sistema nervioso central, controla la EAE, pero no la artritis. Esto confirma que la regulación inducida por el tratamiento es específica del antígeno y del tejido, y por lo tanto de la enfermedad.
Por otra parte, el complejo pMHC-PN no requiere dirigirse a todas las células T específicas para todos los péptidos en el órgano afectado. Incluso los péptidos de antígenos subdominantes (antígenos más débiles que no desencadenan enfermedades en una primera instancia) fueron capaces de inducir células tipo Tr1 capaces de suprimir linfocitos colaboradores y citotóxicos con actividad frente a otros antígenos (figura 1). Por lo tanto, aunque este tratamiento es de elevada especificidad contra el antígeno en fase inductiva, también puede influir en otras vías locales de la respuesta inmune, a través de la inducción de una actividad regulatoria de células B y la supresión de linfocitos T CD4+ y CD8+. Esto requiere que el fragmento del péptido proveniente del antígeno que induce la respuesta y los provenientes de otras fuentes sean presentados por la misma APC.
¿Es posible que tal supresión pueda conducir a la interrupción sistémica del sistema inmune apagando a células que no participan en el proceso de autoinmunidad, aumentando el riesgo de infección o de cáncer? No: Tal supresión indirecta se limita a ganglios linfáticos asociados con al órgano e influye sólo en las APC que presentan el auto-antígeno de interés. Tal especificidad es claramente demostrada en los experimentos con ratones tratados con pMHC-NP, donde se observó una protección contra la autoinmunidad, sin disminuir las respuestas frente a infecciones y a antígenos foráneos.
Los tratamientos experimentales de este estudio utilizan modelos bien caracterizados de patologías autoinmunes. Sin embargo, ¿podría ser que se trate de simplemente otro enfoque terapéutico que funciona exclusivamente para modelos animales y no en humanos? Al parecer, los resultados apuntan a que si funcionarían: los autores mostraron que pMHC-NP conduce a la diferenciación y proliferación de células tipo Tr1 humanas, en ratones inmunodeficientes trasplantados con células T y B de pacientes, demostrando que la terapia funciona con tales células. La investigación, también sugiere que pMHC-PN es más efectivo que el uso de monómeros peptídicos unidos a MHC a una dosis equivalente. Además, este nuevo enfoque parece tener propiedades más supresoras que la aplicación de péptido individual. Sin embargo, las dosis y vías de administración en estos ensayos no fueron comparables.
Existen pruebas contundentes relacionadas a que antígenos peptídicos pueden inducir a células tipo Tr1 y suprimir enfermedades autoinmunes tanto en ratones como en humanos. El hecho que pMHC-NP induzca a células tipo Tr1 de una forma similar a lo observado tras la administración de péptidos individuales, sugiere que el complejo imita el mecanismo de presentación de las APC. El reto con cada uno de estos enfoques será encontrar la dosis óptima y vía de administración para tratar pacientes. A medida que estas opciones terapeuticas progresen a través del conocimiento obtenido en pruebas clínicas, será de vital importancia que su mecanismo de acción sea investigado en detalle para que las personas puedan beneficiarse plenamente de la inmunoterapia específica de antígeno para combatir patologías autoinmunes.
Fuente bibliográfica
Autoimmunity: Antigen-specific immunotherapy
David Wraith
School of Cellular and Molecular Medicine, University of Bristol, Bristol BS8 1TD, UK.
doi:10.1038/nature17300