Tolerancia al embarazo
El aborto involuntario corresponde a la pérdida del embarazo antes de las 20 semanas de gestación. Casi el 20% de las gestaciones terminan en aborto involuntario, por lo general dentro de las primeras 12 semanas. La pérdida recurrente, o aborto involuntario habitual, se define como tres o más pérdidas espontáneas consecutivas. Las posibles causas incluyen el defecto genético, útero de forma anormal, fibromas uterinos, tejido cicatricial, desequilibrios hormonales y algunas enfermedades como la diabetes. El aumento de edad, tabaquismo, consumo de cafeína y alcohol, y el uso de ciertos medicamentos también aumentan el riesgo de interrupción involuntaria.
Sin embargo, incluso si no se determina la causa y no se aplica un determinado tratamiento, con el tiempo las posibilidades de tener un bebé después de sufrir uno o más abortos involuntarios recurrentes son del 60%.
El aborto espontáneo recurrente
Uno de los aspectos más notables de la biología reproductiva es el simple hecho que una mujer sana con un sistema inmune completamente funcional puede llevar con éxito un embarazo semialogénico de término sin rechazo inmunológico. Un estudio reciente realizado por Robert M. Samstein y colaboradores (Cell 2012; 150:29-38) proporciona nuevos conocimientos sobre los mecanismos de tolerancia materno-fetal y sugiere que el conocimiento previo ha sido bastante ingenuo. Ellos también explican por qué los anteriores enfoques sobre la prevención del rechazo inmune del feto por la madre han fracasado y sugieren una mirada alternativa para el tratamiento.
La reproducción humana está lejos de ser perfectamente eficiente, uno de cada cinco embarazos termina en aborto involuntario, y la gran mayoría ocurre en el primer trimestre, comúnmente debido a esporádicas anomalías cromosómicas. El aborto no voluntario recurrente, que se define como dos o más abortos involuntarios, se produce hasta en el 5% de las parejas que intentan concebir. En estos casos, por lo general, el feto es euploide, no existiendo causa alguna para el aborto.
Durante décadas se pensó que un posible motivo era el rechazo del feto por el sistema inmunológico de la madre. La idea que un sistema inmune exacerbado reconoce al feto como un elemento extraño condujo a la utilización de intervenciones terapéuticas, tales como la administración de glucocorticoides e inmunoglobulinas intravenosas, con el objetivo de suprimir al sistema inmune materno. Estas terapias, sin embargo, resultaron en gran parte decepcionantes, la inhibición del sistema inmunológico de la madre no impide el aborto involuntario.
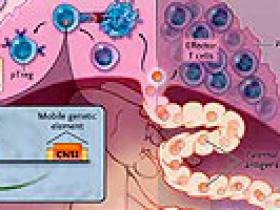
Las células T reguladoras (Treg) son un subconjunto de células T cooperadoras CD4+ inhibidoras que reducen la respuesta inmune a la infección, la inflamación y la autoinmunidad (figura 1). La proteína P3 de la caja de Forkhead (FOXP3), un factor de transcripción expresado por las células T reguladoras, interviene en esta función supresora. Una deficiencia en las Treg, congénita o adquirida, genera una respuesta autoinmune sistémica fatal. Hay dos vías de desarrollo de células T reguladoras: tímica (tTreg) y extra tímica o periférica (pTreg). Recientemente, un elemento potenciador de FOXP3, la secuencia no codificadora conservada 1 (SNC1), ha demostrado ser esencial para la generación de pTreg y no de tTreg, sugiriendo diferentes funciones biológicas de estas dos poblaciones de células. Específicamente, las tTreg parecen suprimir la autoinmunidad, mientras que pTreg pueden limitar la respuesta inmune a los antígenos extraños, tales como los de la dieta, las bacterias comensales y los alérgenos.

Antígenos fetales, incluyendo aloantígenos paternos, construyen una interfaz con el sistema inmune materno dentro de la unidad uteroplacentaria y en ganglios linfáticos proximales. La inserción de un elemento genético móvil que contiene la secuencia no codificante conservada 1 (SNC1) cerca del gen FOXP3 en el momento de la radiación evolutiva de los mamíferos placentarios activaría la aparición de células T reguladoras extra tímicas o periféricas (pTregs) (Panel A). Los aloantígenos paternos desencadenan la expansión de pTreg que suprimen las células T efectoras y mitigan el conflicto materno-fetal inducido por el sistema inmune de la madre. Esto sugiere que cuando pTreg no están, las células efectoras T responden a los aloantígenos paternos, infiltrándose en la placenta para generar cambios inflamatorios que finalmente provocan el aborto espontáneo (Panel B).
La aparición evolutiva de mamíferos placentarios ha proporcionado ventajas de supervivencia, tales como permitir un desarrollo fetal más complejo y proteger. Sin embargo, esto se produjo con el costo de la exposición prolongada a aloantígenos paternos, y por tanto, la necesidad de mitigar el conflicto materno-fetal por el sistema inmune materno. El grupo de R. Samstein y colegas planteó la hipótesis que pTreg surge durante la evolución de los mamíferos placentarios para mitigar dicho conflicto. En apoyo de esta hipótesis es la constatación que SNC1, necesario para el desarrollo de pTreg, está presente en todos los mamíferos placentarios analizados y ausente en los no placentarios tales como el canguro, zarigüeyas y el ornitorrinco, así como en no mamíferos como el pez cebra. Ya que SNC1 se encuentra dentro de un retrotransposón ("gen saltarín") que estaba activo durante la radiación evolutiva de los mamíferos placentarios, los autores sugirieron que la retrotransposición de SNC1 en el locus Foxp3 permitió la aparición de pTreg.
En una serie de experimentos en ratones, ellos demostraron que las pTreg maternas inducidas por el embarazo reconocen específicamente los antígenos paternos. Estas pTreg suprimen las células T efectoras maternas y mitigan la dificultad materno-fetal causada por los aloantígenos paternos. En ratones deficientes para SNC1, la incapacidad de inducir pTreg en la madre resulta en la infiltración de células T activadas en la placenta y en abortos espontáneos.
Estos hallazgos indican que la tolerancia materno-fetal a aloantígenos paternos es un proceso activo en el que las pTreg responden específicamente a los antígenos paternos para inducir tolerancia. Por lo tanto, las terapias no deberían tener como objetivo suprimir el sistema inmune materno sino mejorar la tolerancia. Los resultados son consistentes con un aumento en el porcentaje de células Treg durante el embarazo y no con el aumento de mujeres con pérdida recurrente del embarazo. Estos resultados también proporcionan la plausibilidad biológica aparentemente paradójica de que, en mujeres con antecedentes de aborto involuntario recurrente inexplicable, la administración de filgrastim (factor estimulante de colonias de granulocitos) al inicio del embarazo reduce la tasa de aborto involuntario.
Ahora se empieza a comprender mejor el mecanismo por el cual se protege al feto del rechazo por el sistema inmune materno. Será importante determinar si la inducción aberrante de pTreg es causa de aborto involuntario en los seres humanos y, en caso afirmativo, con qué frecuencia ocurre. A pesar de existir explicaciones para el aborto involuntario recurrente sería enormemente gratificante ver los resultados traducidos en terapias que ayuden a aquellos que sufren de pérdidas involuntarias recurrentes.
Fuente bibliográfica
Inducing Tolerance to Pregnancy
Zev Williams, M.D., Ph.D.
Program for Early and Recurrent Pregnancy Loss, Department of Obstetrics and Gynecology and Women’s Health, Albert Einstein College of Medicine, Montefiore Medical Center, New York.
DOI: 10.1056/NEJMcibr1207279