
Neumol Pediatr 2016; 11 (1): 23 - 27
C o n t e n i d o d i s p o n i b l e e n h t t p : / / www. n e umo l o g i a - p e d i a t r i c a . cl
24
Farmacocinética y farmacodinámica de antibióticos utilizados en pacientes pediátricos con fibrosis quística
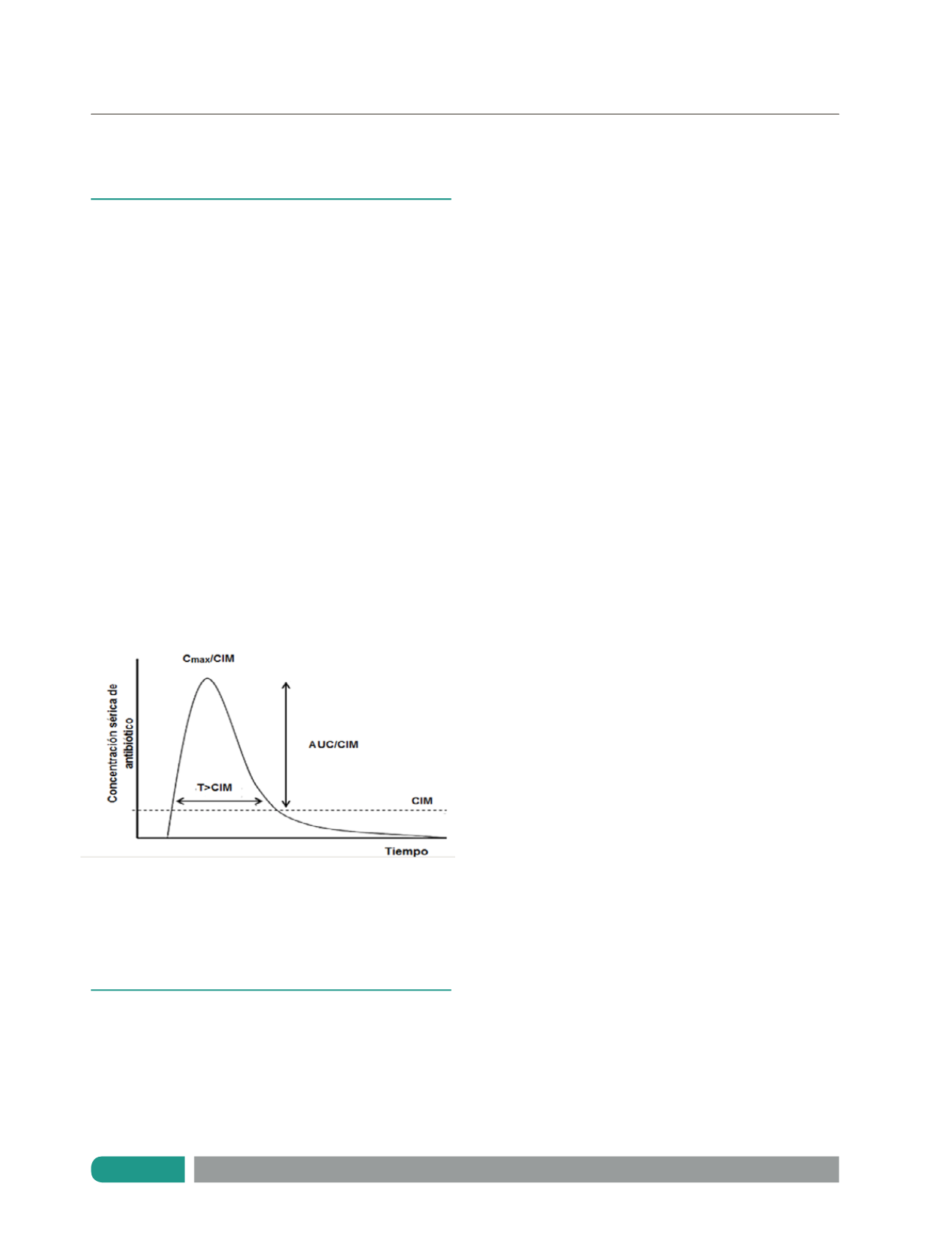
CLASIFICACIÓN FARMACOCINÉTICA/FARMACODINÁMICA DE
LOS ANTIMICROBIANOS
Los modelos farmacocinéticos/farmacodinámicos
clasifican a los antimicrobianos en tres tipos (Figura 1):
• Concentración dependiente (Cmax/CIM)
Para estos antibióticos su eficacia clínica se maximiza
entre mayores sean las concentraciones plasmáticas en
relación a la CIM del patógeno causante de la infección. A
este grupo pertenecen los aminoglucósidos (6).
• Tiempo dependiente (T>CIM)
El efecto del antibiótico aumenta cuando es mayor el
tiempo en que la concentración del antimicrobiano supera
al menos 4 veces el valor de la CIM dentro del intervalo
de dosificación. Los
β
-lactámicos siguen este modelo de
optimización (6).
• Concentración dependiente según el tiempo (ABC/CIM)
En estos casos el efecto clínico del antimicrobiano
depende de las concentraciones plasmáticas y del tiempo
que se supere la CIM de la bacteria. A esta clasificación
corresponden la vancomicina, las fluoroquinolonas y el
trimetropim/sulfametoxazol (6).
CAMBIOS FARMACOCINÉTICOS DE ANTIMICROBIANOS EN
PACIENTES PEDIÁTRICOS CON FIBROSIS QUÍSTICA
En los pacientes pediátricos ocurren una serie de
cambios farmacocinéticos, situación que genera una dificultad
a la hora de dosificar los medicamentos en especial los
antimicrobianos, en los cuales la obtención de concentraciones
subterapéuticas favorece la aparición de cepas bacterianas
multiresistentes (7,8). Dentro de los cambios farmacocinéticos en
pacientes pediátricos destacan:
• Distribución
La distribución del fármaco en el organismo viene
determinada por las propiedades físico-químicas de éste y por
los factores fisiológicos específicos del paciente. Durante los 2
primeros años de vida y desde el inicio del desarrollo fetal, el
porcentaje relativo de agua corporal va declinando, esto implica
que el volumen de distribución de fármacos hidrosolubles, como
los antimicrobianos betalactámicos, amikacina y vancomicina,
será más elevado en los neonatos y lactantes que en los niños
pequeños y adultos. La traducción de estos conceptos a la
práctica clínica implica la administración de dosis más elevadas
de antimicrobianos, para obtener concentraciones plasmáticas
bactericidas (9).
• Metabolismo
El metabolismo de los medicamentos puede variar
en cuanto a velocidad y vía metabólica empleada, en función
de la edad gestacional, postnatal y por algunas patologías. El
aclaramiento plasmático de aquellos medicamentos que poseen
un amplio metabolismo hepático, por ejemplo amoxicilina
con ácido clavulánico, estará disminuido en los neonatos e irá
incrementando progresivamente con la edad, es por ello, que en
esta población es necesario ajustar la dosis de los antimicrobianos
que sufran un extenso metabolismo hepático (10).
• Excreción
El riñón además de sus funciones fisiológicas es el órgano
encargado de eliminar los medicamentos ya sea en forma inalterada,
como metabolitos activos o inactivos. Los fármacos se excretan por
filtración glomerular y por secreción tubular activa, siguiendo los
mismos pasos y mecanismos de los productos del metabolismo (7,11).
El filtrado glomerular de un medicamento depende de la unión a
proteínas plasmáticas, del flujo sanguíneo renal y de la superficie
de filtración. Por todas las variables mencionadas anteriormente
recién entre los 8 y 12 meses la velocidad de filtración glomerular
alcanza los valores del adulto; aunque por sobre el año de vida
los valores de filtración glomerular en niños superan los valores
de la adultez (8,12). El cambio permanente de la función renal
durante la etapa pediátrica genera una alta variabilidad en las
concentraciones plasmáticas de los antibióticos dado que un gran
porcentaje de éstos se eliminan por vida renal.
En lo que respecta a los pacientes FQ, todos los
cambios farmacocinéticos planteados anteriormente son más
notorios. Por ejemplo, la ceftazidima tiene un aclaramiento renal
en promedio de 125 ml/minutos en pacientes FQ versus los 100
ml/minutos en pacientes sanos (13,14). Otro ejemplo es la vida
media de amikacina, en pacientes con fibrosis quística tiene un
valor promedio de 55 minutos, valor menor a los 100 minutos de
promedio en pacientes sanos (15). Además, en la fibrosis quística
existe alteración de la distribución por la hipoalbuminemia e
hipogamaglobulinemia existente, ya que la disfunción hepática
reduce la producción de proteínas. El aclaramiento hepático
de muchos fármacos está alterado por el incremento del flujo
circulatorio hepático y por el incremento de la actividad de algunas
enzimas hepáticas.
Cmax: Concentración máxima, T: Tiempo, CIM: Concentración inhibitoria
mínima, AUC: Área bajo la curva. Copia y adaptación autorizadas por
Escobar L. Pharmacokinetic considerations in critically ill patients. Rev
Med Chile 2012; 140: 780-788.
Figura 1.
Modelos farmacocinéticos/farmacodinámicos de
antibióticos
















