Regulación celular de la inflamación intestinal
El reconocimiento celular de moléculas propias del organismo y foráneas, es un punto clave para el control de la respuesta inmunológica. La selección tímica, permite elegir los linfocitos T que ignoran antígenos propios, mientras que los que experimentan un fuerte reconocimiento de lo propio son eliminados por apoptosis, evitando la autoinmunidad. De una forma similar, en el intestino, células linfoides innatas del grupo 3 (ILC3, por sus siglas en inglés) inducen la muerte de células T que se unen vigorosamente a antígenos de bacterias no patogénicas, constituyentes de la microbiota intestinal y por consecuencia, impiden la autoinflamación y un potencial daño a los tejidos. Recientes investigaciones realizadas en ratones, han mostrado que el mecanismo por el cual esto se lleva a cabo es mediado por la presentación de antígenos vía complejo mayor de histocompatibilidad de clase II (MHCII), proteína de superficie de las ILC3 que permite la exhibición de moléculas propias y foráneas a los linfocitos, eliminándose aquellos que reaccionan frente a tales antígenos. Adicionalmente, en pacientes pediátricos con enfermedad inflamatoria intestinal se han observado niveles reducidos de MHCII, lo cual sugiere que la patogénesis está mediada por una falta de presentación de antígenos y posterior eliminación de células reactivas. Eventualmente, la potenciación de la actividad de las ILC3, representa una importante estrategia para el tratamiento de enfermedades inflamatorias que afectan el intestino.
Autoinmunidad y tolerancia
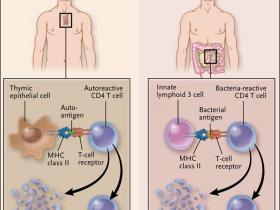
El sistema inmunológico en el oranismo camina sobre una delgada cuerda. Debe reconocer millones de señales potenciales de peligro. Pero luego de haber ideado maneras de reconocer tales amenazas, además debe asegurarse de no atacar objetivos que podrían resultar en autolesiones. En su mayor parte, lo anterior se logra admirablemente. Sin embargo, de vez en cuando, ocurre un paso en falso, desencadenando algunos resultados como artritis reumatoide, lupus eritematoso sistémico, y la enfermedad de Graves. Para evitar una agresión contra sí mismo, el epitelio del timo muestra antígenos propios a los linfocitos T, eliminando aquellos que tienen el potencial de causar una patología autoinmune (fig. 1). Otros chequeos y balances, también se llevan a cabo, por ejemplo por las células T reguladoras, sin embargo, es el timo el que tiene en esto el rol principal .
Aprender a ignorar antígenos propios es sólo una parte del desafío: el sistema inmunitario debe también aceptar determinados antígenos foráneos. De hecho, esto representa una obligación esencial del sistema inmunológico. Es asunto de imaginar las consecuencias que traería que los linfocitos batallaran constantemente contra bacterias en la boca, la piel, o el intestino. Pero, ¿cómo hace el sistema inmunológico para que los linfocitos adopten una actitud permisiva hacia bacterias no patogénicas? En una publicación reciente, Hepworth y sus colegas (Science. 2015 May 29;348(6238):1031-5) describen un mecanismo que tiene importantes implicaciones para la comprensión de la enfermedad inflamatoria intestinal.
El sistema inmunitario, por lo general es conceptualizado en dos divisiones: una respuesta innata y una respuesta adaptativa. La división innata incluye neutrófilos y macrófagos. Las células de este grupo tienen receptores para reconocer productos microbianos. Pueden responder rápida e indiscriminadamente a una señal de peligro. En contraste, la división adaptativa, que incluye linfocitos T y B, pueden reorganizar genes, tales como los codificantes para inmunoglobulinas o receptores de antígenos y de esta forma lograr una respuesta dirigida y altamente precisa. Este proceso lleva tiempo, por lo que - a pesar de que es más selectivo - la respuesta adaptativa es más lenta en ofrecer protección.
Sin embargo, analizar el sistema inmunológico humano solo en dos divisiones, es simplificar. Esto es debido a que también posee células que incorporan aspectos de ambos tipos de respuestas. Tales células, parecidas a los linfocitos, han sido denominadas como células linfoides innatas y están implicadas en el solapamiento de ambas respuestas. A diferencia de los linfocitos del sistema adaptativo, estas células no pueden realizar reordenamientos génicos de sus receptores de antígenos. A pesar de ser superadas en número ampliamente por los linfocitos convencionales, se encuentran involucradas en una matriz de enfermedades, especialmente las relacionadas con las mucosas de superficies como la piel, intestino, o el pulmón.
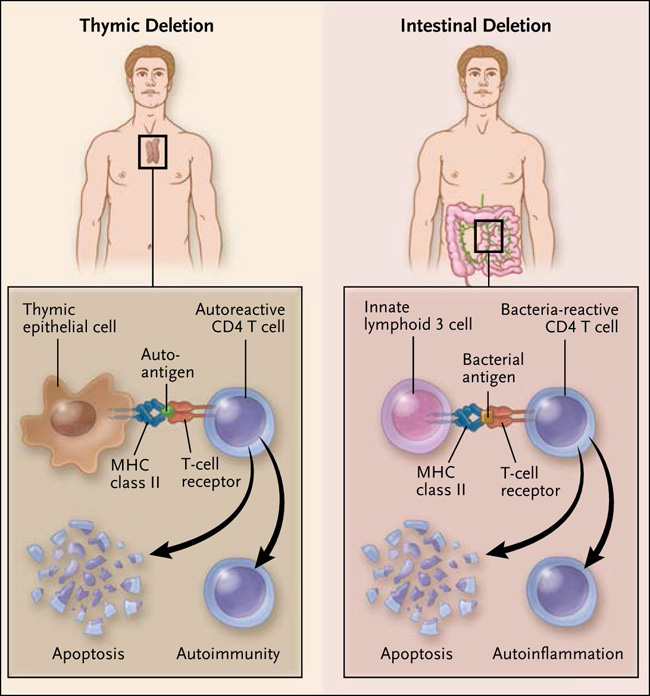
Figura 1. Autoinmunidad y autoinflamación.
El timo es responsable de eliminar las células T autorreactivas que tienen el potencial para causar enfermedades autoinmunes. Las células epiteliales medulares o células dendríticas en el timo presentan antígenos en asociación con una molécula de la superficie celular, conocida como MHC de clase II. El antígeno es reconocido por el receptor de células T. Si el reconocimiento es fuerte, el linfocito T autorreactivo es eliminado mediante apoptosis. El fallo en la eliminación de tales células resulta potencialmente en una autoinmunidad. Las células ILC3 (un subconjunto de células linfoides innatas) en la lámina propria del intestino o en el ganglio linfático mesentérico, realizan una función similar, excepto que las células T que se eliminan son aquellas que reconocen antígenos bacterianos y por lo tanto podrían causar enfermedad inflamatoria intestinal. Como en el timo, las células ILC3 utilizan al MHC de clase II para presentar antígenos a linfocitos T. Si un antígeno bacteriano es fuertemente reconocido por la célula T, esta sufre apoptosis. Estas células, al no ser eliminadas, conducen a una inflamación que puede ser catalogada como autoinflamatoria.
Hepworth y sus colegas manipularon genéticamente ratones para obtener un deterioro de un subconjunto de células linfoides innatas llamadas ILC3. La capacidad de tal modificación se basa en el conocimiento de que las ILC3 son únicas en su perfil de expresión de genes específicos. Utilizando un sistema de bioingenería, los investigadores eliminaron un gen codificante para un componente crítico del MHC II en este tipo celular. Este complejo proteico (MHC II), en circunstancias normales, presenta antígenos que a su vez son reconocidos por otro tipo celular: los linfocitos T CD4.
La enfermedad de Crohn y la colitis ulcerosa se caracterizan por una disbiosis, lo que implica un cambio en las bacterias que colonizan el intestino. En personas con la primera patología, los linfocitos T CD4, que en individuos sanos ignoran a estos microorganismos del intestino, tienen una respuesta exacerbada la que se correlaciona con la inflamación de este órgano y con el desarrollo de la enfermedad. Puesto que este trastorno inflamatorio no es el resultado de un ataque contra antígenos propios, no debe ser catalogada como autoinmune. Algunos han propuesto que el término autoinflamatorio es una denominación más apropiada.
Experimentos realizados en ratones que carecían de MHC de clase II propio de las ILC3, mostraron que bajo esa condición, desarrollaban inflamación intestinal, trastorno similar a la enfermedad de Crohn. Los investigadores, encontraron además que estos poseían un exceso de linfocitos que reconocen antígenos bacterianos. En contraste, células T que reconocen antígenos no bacterianos parecen no ser afectados, al igual que los linfocitos T reguladores. Sorprendentemente, las ILC3 pueden presentar el antígeno de una manera que es análoga a la forma en que una célula dendrítica activa una célula T para lograr una respuesta específica en el timo. Sin embargo las ILC3 carecen de las moléculas accesorias necesarias para producir la activación. En lugar de la activación, las ILC3 residentes en la lámina propria del intestino y en ganglios linfáticos mesentéricos, eliminan selectivamente linfocitos que son capaces de responder a antígenos bacterianos originarios de este órgano. Así como epitelio tímico impide una autoinmunidad, las ILC3 pueden prevenir la enfermedad autoinflamatoria en el intestino.
Aunque esta observación por sí sola proporciona un salto en la comprensión de la regulación de la respuesta inmune, los autores extendieron su trabajo mediante el análisis de especímenes de biopsias intestinales de niños con la enfermedad de Crohn. Tales muestras, revelaron una deficiencia en la expresión de MHC de clase II ILC3-intrínseca, lo que sugiere que la patogénesis en seres humanos podría imitar la del modelo de ratón. La potenciación de la respuesta ILC3 en el intestino lo que podría ser logrado por citoquinas, factores de crecimiento, o incluso transfusión de células ILC3 autólogas después de cultivarlas in vitro, representa una estrategia potencial para el tratamiento de trastornos inflamatorios del intestino. Así como es fundamental entender cómo nuestro sistema inmunológico puede reconocer un antígeno extraño, es igualmente importante comprender cómo el sistema inmune aprende a dejar que los eventos sigan su curso por sí mismos.
Fuente bibliográfica
The Immune Response — Learning to Leave Well Enough Alone
James T. Rosenbaum, M.D.
Casey Eye Institute and the Legacy Devers Eye Institute — both in Portland, OR.
DOI: 10.1056/NEJMcibr1511284