Neuronas sensoriales para el dolor y la inflamación
Una densa red de nervios sensoriales inervan los tejidos periféricos, incluyendo la piel, las vías respiratorias y el tracto gastrointestinal, que a menudo suelen estar expuestos a bacterias patógenas. La infección induce la inflamación a través del reclutamiento de células inmunes. A su vez, el dolor inflamatorio durante el proceso infeccioso activa la acción de proteínas inmunes (por ejemplo, citoquinas y factores de crecimiento), lípidos (por ejemplo, prostaglandinas), y otros mediadores como aminas, potasio y protones, sobre los receptores expresados por los nociceptores.
Por otra parte, el S. aureus es causa importante de infecciones en las heridas y en procedimientos quirúrgicos, dando lugar a dolorosos abscesos, celulitis y fascitis necrotizante. La bacteria libera toxinas como las hemolisinas, leucocidina de Panton-Valentine (L-PV) y modulinas solubles en fenol, que juegan un papel importante en la diseminación bacteriana y en el daño tisular. Inesperadamente, las principales vías de activación inmune no son necesarias para la hiperalgesia durante la infección aguda. Más bien, las bacterias activan directamente a los nociceptores a través de los péptidos N-formilo y la toxina formadora de poros alfa-hemolisina. Por último, se sabe que los nociceptores liberan neuropéptidos que modulan la activación inmune innata durante la infección.
Bacterias y el código neural
El enfoque actual para el diagnóstico definitivo de la infección requiere del análisis de los fluidos o tejidos del cuerpo, a menudo obtenidos a través de procedimientos invasivos. Los resultados de estas pruebas pueden tardar horas, días, o incluso más. Sin embargo, el diagnóstico oportuno y la rápida intervención son esenciales para minimizar la morbilidad y mortalidad de los pacientes. Por ejemplo, para un individuo con shock séptico, la administración de agentes antibióticos es prioritaria, ya que cada hora de retraso se asocia a un aumento en la mortalidad. Por otra parte, los estudios demuestran que el sistema nervioso detecta y responde a la infección e inflamación, lo que sugiere que su actividad es más informativa de lo que generalmente se ha percibido.
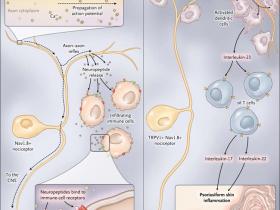
En experimentos en ratones, se ha observado que las moléculas producidas por el Staphylococcus aureus, tales como los péptidos formilados y la toxina α-hemolisina, activan directamente a un grupo de neuronas sensoriales que incluye los nociceptores. La activación neuronal se produce a través de la interacción directa entre los productos bacterianos y las proteínas de la membrana neuronal FPR1 y ADAM10. Este mecanismo de detección omite el sistema inmune innato; además, cuando estas neuronas sensoriales son suprimidas, la infección con el patógeno resulta en una mayor infiltración inmune y en una linfadenopatía debido a la disminución de la liberación de neuropeptidos inmuno-moduladores. Por lo tanto, las señales neuronales, propagadas a través de los reflejos axón-axón, culminan en la liberación local de CGRP, galanina y somatostatina en el sitio de la infección (figura 1). La participación de los receptores neuronales por ligandos afines, a su vez, regula la actividad de la infiltración de células inmunes, limitando la inflamación y el daño.
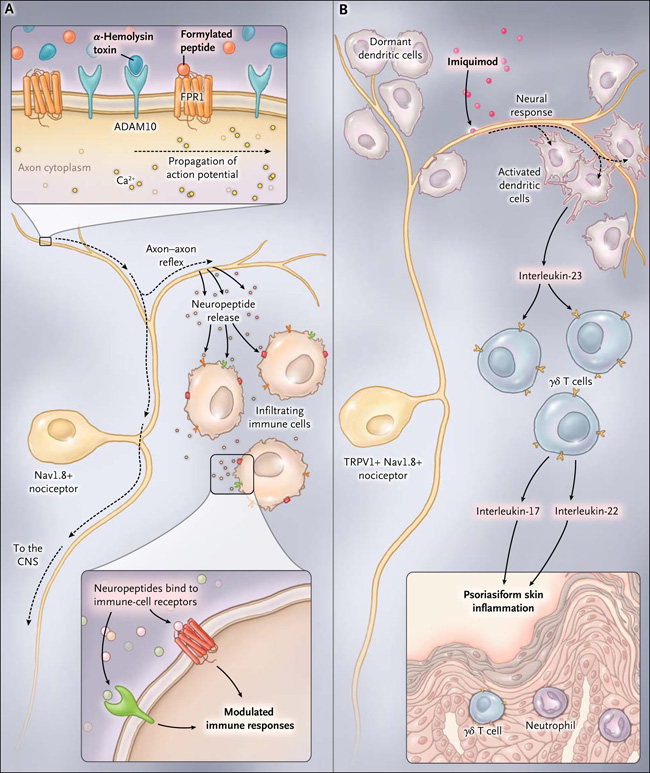
Figura 1: señalización y modulación neuronal del medio inmune local
Subconjuntos de neuronas sensoriales pueden ser capaces de reunir información sobre el medio infeccioso e inflamatorio local para modular las respuestas inmunes. En el panel A, péptidos formilados y la toxina α-hemolisina del Staphylococcus aureus activan los nociceptores Nav1.8+ a través de FPR1 y ADAM10, respectivamente. La activación neuronal conduce a un reflejo axón-axón (línea negra discontinua) generando señales que se propagan a los terminales nerviosos y a la liberación de neuropéptidos tales como CGRP, galanina y somatostatina. Estos mediadores se unen a sus receptores en la infiltración de células inmunes y modifican la respuesta inflamatoria local. En el panel B, los nociceptores TRPV1+ Nav1.8+ conducen a una inflamación de la piel tipo psoriasis inducida por imiquimod tópico. Estos nervios sensoriales periféricos están en estrecha proximidad a las células dendríticas dérmicas produciendo interleucina-23. Esta última, activa las células T γδ, que liberan interleucina-22 e interleucina-17, inflamando la piel y activando y proliferando los queratinocitos. CNS denota sistema nervioso central.
Un trabajo reciente de investigadores independientes, mostró que un subconjunto de neuronas en ratones modula la respuesta inflamatoria cutánea en la inflamación psoriásica de la piel mediante la regulación de las respuestas de citoquinas de las células dendríticas de la piel (figura 1B). En la psoriasis, la denervación farmacológica de las neuronas sensoriales nociceptivas durante la inflamación inducida por imiquimod tópico disminuye la hinchazón y la inflamación local (que sugiere además que no hay control neuronal directo de la inflamación cutánea). Estas mismas neuronas terminan en las células dendríticas residentes que generan la interleucina-23, accionando una cascada de citoquinas y en última instancia, generando la inflamación de la piel psoriásica. La naturaleza de la interacción entre neuronas y células dendríticas aún no está clara y debe ser el foco de más investigación. Juntos, estos estudios indican que las neuronas sensoriales pueden integrar información sobre el entorno infeccioso e inflamatorio local para modular las respuestas inmunes por reflejo.
También han sido implicadas las neuronas autónomas en la regulación de la inflamación. Por ejemplo, en un reciente el trabajo seminal, la vagotomía subdiafragmática impidió la pirexia en ratones que recibían interleucina-1β. Los circuitos reflejos autónomos, por lo tanto, perciben señales inmunes e inflamatorias dentro de las vísceras. Si los mediadores inflamatorios activan directamente estas neuronas - como parece ser el caso en las neuronas sensoriales nociceptivas - o si los pasos intermedios conducen a la activación neuronal autónoma, es un área de investigación por llevar a cabo. Notablemente, como la infección genera respuestas inmunes y fisiológicas, dichos cambios son monitoreados en tiempo real por las redes neuronales sensoriales periféricas. Se deduce que un conjunto de información relacionado con las reacciones fisiológicas, metabólicas e inmunológicas, estaría disponible para el sistema nervioso, movilizando procesos antimicrobianos, al menos en algunos contextos.
La densidad de la red neuronal sensorial asegura que virtualmente todas las células en el cuerpo pueden interactuar eléctricamente y comunicar la información aferente al cerebro sobre el estado inmune del cuerpo. Es posible que las firmas neuronales codificadas en estas señales eléctricas sean específicas de un patógeno dado, así como para la respuesta del huésped, es decir, el sistema nervioso puede ser capaz de discriminar no sólo la ubicación de una infección, sino también el tipo de patógeno causante. Se postula que la obtención y decodificación de esta información a través de registros nerviosos permitiría el diagnóstico y seguimiento del curso de una enfermedad infecciosa.
Prueba de esta hipótesis requerirá de conocimiento adicional en medicina y en la ingeniería. Una vez disponible, un conjunto de firmas eléctricas microbiológicas podría extenderse a la terapéutica, para generar antibióticos personalizados, terapias inmunomoduladoras o tratamientos que incluso sean entregados por la replicación de estas firmas. Como se ha podido demostrar, la capacidad funcional de las neuronas sensoriales se extiende más allá de informar sobre los problemas ambientales e incluye activos efectos inmuno reguladores. En principio, mediante la combinación de la escritura y lectura de la información neural, se podrían establecer sistemas cerrados que modulen las respuestas inflamatorias o inmunes para mejorar los resultados del paciente.
Fuente bibliográfica
Bacteria and the Neural Code
Benjamin E. Steinberg, M.D., Ph.D., Kevin J. Tracey, M.D., and Arthur S. Slutsky, M.D.
Department of Anesthesia, University of Toronto (B.E.S.), and the Keenan Research Centre for Biomedical Science, St. Michael's Hospital (A.S.S.) — both in Toronto; and the Laboratory of Biomedical Science, Feinstein Institute for Medical Research, Manhasset, NY (K.J.T.).
N Engl J Med 2014; 371:2131-2133