Nanopartículas y ayuda antiviral contra el cáncer
Los órganos linfoides, en los que las células presentadoras de antígenos (APC) están en estrecha proximidad a las células T, son el microambiente ideal para la potenciación y amplificación de las respuestas de este tipo celular. Sin embargo, la administración sistémica de vacunas contra antígenos tumorales para activar células dendríticas se ve obstaculizada por varios retos técnicos. Recientes investigaciones realizadas en ratones y en tres pacientes, muestran que esto puede ser logrado con precisión y eficacia mediante la administración intravenosa de un complejo nanomolecular formado por lípidos y ARN, sin la necesidad de partículas como anticuerpos o ligandos adicionales. El ARN recubierto y protegido por la estructura lipídica, codifica antígenos tumorales capaces de estimular a las células presentadoras de antígeno, simulando además las vías activadas mediante el transcurso de una infección viral al impulsar a linfocitos T CD8 a ejercer su actividad citotóxica. Esta respuesta sumada a la producción y secreción de interferón, constituye un enfoque promisorio para estudios clínicos más amplios que otorguen resultados positivos para la lucha contra el cáncer.
Vacuna antitumoral
Las vacunas preventivas son quizás la forma más eficaz de inmunoterapia. Sin embargo en un artículo reciente liderado por Lena M. Kranz, se describió una estrategia de vacunación contra el cáncer dirigida a tumores preexistentes mediante el reclutamiento de mecanismos que usualmente son usados durante el transcurso de una infección viral. Los investigadores emplearon nanopartículas en cuyo interior llevan ARN tumoral para simular la intrusión de un patógeno viral en el torrente sanguíneo. Cuando las nanopartículas alcanzan los tejidos linfoides, como el bazo y los ganglios, activan los mecanismos de defensa antivirales en componentes del sistema inmunológicotales, como las células dendríticas (CD). Estas células, traducen el ARN proveniente de las nanopartículas para expresar y presentar antígenos tumorales (moléculas utilizadas durante una respuesta inmunitaria como objetivos de ataque) a los linfocitos T, estimulando a estas células para iniciar una respuesta antitumoral.
¿Por qué es tan difícil obtener una vacuna efectiva contra el cáncer? Una razón es que las células cancerosas son similares en muchos aspectos a las normales y el sistema inmunitario evita atacar lo propio. Únicamente se han alcanzado respuestas relativamente modestas con las vacunas que contienen antígenos también expresados en tejidos sanos. Una respuesta de mayor intensidad solamente puede esperarse cuando las células tumorales expresan antígenos que no son usualmente producidos en las células adultas normales.
Otra razón es que el crecimiento cancerígeno no se acompaña de fuertes señales inflamatorias, tales como las que ocurren durante una infección microbiana, las que estimulan una fuerte respuesta inmune. Esto conduce a microambientes tumorales en los que las células de defensa toleran, o incluso promueven, el crecimiento del tumor. Por lo tanto, las vacunas antitumorales deben trabajar cuando la enfermedad ya se ha afianzado, y a menudo, cuando se ha extendido por todo el cuerpo. Por último, y en un contraste clave para las vacunaciones preventivas contra los virus, la mayoría de los cánceres coexisten y han coevolucionado junto a nuestro sistema inmunológico a lo largo de los años, resultando en un microambiente tumoral inmunosuprimido que añade un obstáculo extra para la inmunoterapia.
En los enfoques vacunales contra una amplia gama de enfermedades, las células presentadoras de antígeno (CPA) especializadas poseen un papel fundamental. Particularmente, las células dendríticas están extremadamente bien adaptadas para el procesamiento y presentación de antígenos para activar a los linfocitos T. Las CD de cultivo cargadas con antígenos bajo condiciones in vitro, pueden aumentar la inmunidad cuando se administran a pacientes con cáncer, pero hasta ahora la eficacia clínica de esta estrategia ha sido limitada. La mayoría de estas vacunas utilizan CD derivadas de un tipo particular de glóbulos blancos de la sangre llamados monocitos. Adicionalmente, también ha sido investigada la activación ex vivo de diferentes subconjuntos de CD que circulan de forma natural en la sangre, utilizando varios tipos celulares incluyendo a células dendríticas plasmocitoides (CDp), que producen altos niveles de interferón-α (IFN-α) tras una infección viral.
Los inmunólogos también han explorado las vacunas destinadas a activar directamente las CD del propio paciente en condiciones in vivo, lo que evita el laborioso y costoso cultivo in vitro. Tal enfoque requiere al menos tres componentes: una "etiqueta de dirección" (un anticuerpo específico para las CD o una molécula ligando como un hidrato de carbono dirigido a la CD); un antígeno tumoral; y un compuesto que prepara a las CD para activar completamente a los linfocitos T (por lo general un ligando para un receptor de tipo Toll,TLR). Las nanopartículas que contienen el antígeno y los ligandos de TLR, junto anticuerpos u otros ligandos, han demostrado su eficacia en modelos animales, y actualmente se están llevando a cabo ensayos clínicos incipientes utilizando conjugados de anticuerpos dirigidos a CD unidos a un antígeno tumoral.
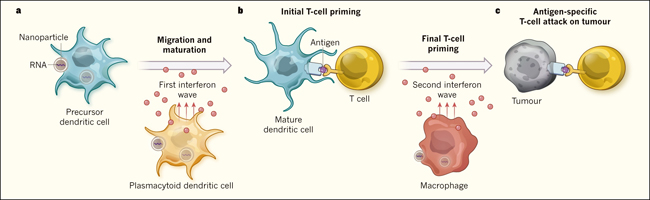
Figura 1. Una vacuna antitumoral de nanopartículas.
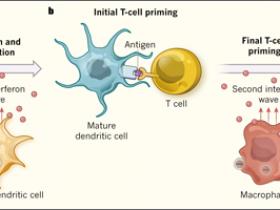
a, Kranz y colegas sintetizaron nanopartículas (complejos de lípidos que contienen ARN codificante para antígenos tumorales), y evidenciaron que son capaces de dirigirse a células dendríticas y macrófagos en ratones. La absorción de nanopartículas por parte de células dendríticas precursoras promueve su maduración a células presentadoras de antígenos, con capacidad migratoria y estimuladora de linfocitos T. La incorporación de las nanopartículas por células dendríticas plasmocitoides promueve la secreción de una ola inicial de interferón que ayuda a generar los primeros pasos de la activación de células T. b, Tras la traducción del ARN dentro de las nanopartículas, las células dendríticas maduras son capaces de expresar antígenos tumorales y presentarlos a los linfocitos. Los macrófagos, por su parte, al incorporar estos nanocomponentes producen una segunda oleada de interferón, que "ceba" completamente a las células T contra antígenos específicos. c, Finalmente, las células T activadas atacan a las células tumorales.
Kranz y sus colegas han desarrollado un tipo diferente de vacuna basadas en nanopartículas, que no requiere de anticuerpos o ligandos para dirigirse hacia las CD. En lugar de ello, sintetizaron nanopartículas consistentes en complejos lipídicos + ARN. A través de este método, los autores demostraron que, al producir nanopartículas ligeramente cargadas en forma negativa (manipulando la proporción lípidos / ARN) pueden dirigirse a los compartimentos que contienen CD en el bazo y otros tejidos linfoides al inyectarlas por vía intravenosa en ratones. Mediante el uso de nanopartículas que llevan ARN que codifica una proteína fluorescente, los autores observaron que la distribución dentro del cuerpo era más dependiente de la carga global de la nanopartícula que del tipo de lípido utilizado. La fluorescencia se observó en las CPA como macrófagos y en las ya mencionadas CD (ambos capaces de expresar el marcador molecular CD11c) en la zona marginal del bazo y en otros órganos linfoides. La fluorescencia no se pudo apreciar en los ratones en los que se eliminó la población de células CD11c +. Además, las CDp no presentaron fluorescencia, pero evidenciaron otras respuestas de señalización que indicaron una incorporación de las nanopartículas.
Los investigadores encontraron que la absorción de las nanopartículas de ARN se produjo por un proceso basado en la membrana celular denominado micropinocitosis. La incorporación fue mayor en los macrófagos. Sin embargo, la más alta expresión de marcador fluorescente codificado por el ARN ocurrió en las CD, lo que indica que son más eficaces que los macrófagos en permitir el transporte del ARN hacia el citoplasma y en traducirlo en proteína.
Curiosamente, los autores observaron dos "ondas" transitorias de IFN después de la administración de nanopartículas (figura 1): la primera fue producida por CDp y alcanzó un máximo a las 2-3 horas después de la inyección. Esto fue seguido de un segundo evento, que fue producido por macrófagos alrededor de 6-8 horas más tarde. Al poner a prueba una serie de ratones genéticamente modificados, los autores evidenciaron que la secreción de IFN era mediada por el receptor TLR y que la primera de las ondas es necesaria para que las CD precursoras maduren y migren para encontrarse con linfocitos T en el bazo y en los ganglios linfáticos. Esto conduce a una respuesta de células T de una gran intensidad (ayudada por la segunda onda de liberación de IFN) frente a una amplia gama de antígenos en ratones modelo de tumores, observándose además la generación de una robusta y prolongada respuesta antitumoral.
Los autores extendieron su investigación a un estudio clínico en pacientes con melanoma, usando nanopartículas que transportan ARN codificantes para antígenos tumorales, presentando los resultados de los primeros tres pacientes tratados. Sorprendentemente, se observó una respuesta inmunitaria, aunque todavía es pronto para asegurar el éxito, por lo que se necesitan de ensayos más amplios y aleatorizados para validar estos hallazgos. Los tres pacientes produjeron IFN y desarrollaron fuertes respuestas por parte de linfocitos T contra los antígenos, incluso ocupando una dosis más baja que en el estudio en ratones. Las respuestas de las células T involucraron a linfocitos CD4 y CD8. La activación de estos últimos es típico de una respuesta antiviral, por lo que al contar con ambos tipos de respuesta se mejora la actividad anticancerígena.
Los autores utilizaron una inyección intravenosa para la entrega de las nanopartículas, pero sería interesante explorar otras vías de administración, lo que podría modificar su distribución. También sería relevante examinar la distribución tisular de nanopartículas radiomarcadas en los pacientes como en los experimentos con ratones, para ver si también se dirigen principalmente a células que expresan CD11c. Otras células del sistema inmunológico que también poseen el marcador CD11c, tales como los neutrófilos y monocitos, igualmente tienen una alta capacidad de fagocitosis, por lo tanto, podrían ser capaces de incorporar nanopartículas y activarse. Si esto es así, no está claro aún cuál es la contribución de estos otros tipos celulares en cuanto a la producción de señales del sistema inmune, como las citoquinas.
El estudio de Kranz y sus colegas remarca el papel de IFN en la obtención de una respuesta robusta por parte de los linfocitos T contra los tumores. Notablemente, se observó este tipo de respuestas en células T CD8 y CD4, tanto en ratones como en humanos. A pesar de que se sabía con anterioridad que los linfocitos T CD8 son el principal tipo celular que actúa en la erradicación tumoral, diferentes subtipos de CD estimulan diferentes tipos de linfocitos citotóxicos, por lo que la contribución estos últimos puede estar subestimada. Las respuestas en los tres pacientes con cáncer son interesantes, dados los diferentes tipos de antígenos tumorales explorados (incluyendo antígenos que no son expresados generalmente en tejido adulto y nuevos antígenos que surgen como consecuencia de mutaciones en células tumorales). Esta plataforma nanotecnológica puede dar un fuerte impulso al campo de las vacunas, y los resultados de los estudios clínicos venideros tendrán una gran relevancia.
Fuente bibliográfica
Immunotherapy: Cancer vaccine triggers antiviral-type defences
Jolanda de Vries and Carl Figdor.
Department of Tumor Immunology, Radboud Institute for Molecular Life Sciences, Radboud University Medical Center, 6525 GA Nijmegen, the Netherlands.
doi:10.1038/nature18443
Temas Relacionados