Las redes patogénicas de la fibrosis
El envejecimiento promueve la inflamación, un proceso que contribuye a la fibrosis y disminución funcional de los órganos. La investigación biológica sobre esta materia ha permitido determinar que la liberación de trampas extracelulares (NET) desde neutrófilos, proceso denominado NETosis es orquestada por una enzima llamada peptidil arginina desaminasa 4 (PAD4), y contribuye al deterioro de órganos en modelos animales para el estudio de procesos inflamatorios agudos. Se determinó que la NETosis es más prevalente en ratones de edad avanzada y se investigó el papel de PAD4 / NET en la fibrosis de órganos relacionados con la edad. Los autores observaron una mayor reducción de la fibrosis en los corazones y pulmones de roedores envejecidos que no expresaban la enzima, en comparación con ratones de tipo salvaje (WT). Interesantemente, se observó un incremento en la deposición de colágeno intersticial en el ventrículo izquierdo y un descenso en la función sistólica y diastólica solo en ratones WT, y no en ratones PAD4 -/-. En un modelo experimental de fibrosis cardíaca, la sobrecarga de presión indujo NETosis y un reclutamiento plaquetario significativo en animales WT pero no en roedores PAD4 -/-. Por lo tanto, estos hallazgos postulan la inhibición de la enzima PAD4 como una posible opción terapéutica y dan a conocer un papel relevante de las NET en la fibrosis cardíaca y disfunción de órganos asociada con la edad.
Trampas celulares
La fibrosis involucra una deposición excesiva de matriz extracelular durante un proceso reparativo o reactivo tras un daño tisular. Tal evento, que puede ocurrir durante la inflamación crónica y el envejecimiento, contribuye sustancialmente a la enfermedad y a la muerte. Afecta órganos esenciales como el corazón, los pulmones, y el hígado. En el corazón, la fibrosis contribuye a fallas sistólicas y diastólicas. Por otro lado, las opciones de tratamiento actual para los trastornos fibróticos son escasas y la mayoría de las estrategias que se han probado no han tenido éxito. Recientemente, Kimberly Martinod y sus colegas (J Exp Med. 2017 Feb;214(2):439-458) han postulado nuevas ideas sobre los mecanismos subyacentes a la fibrosis tisular, lo que podría ofrecer nuevos enfoques para abordar o prevenir esta patología.
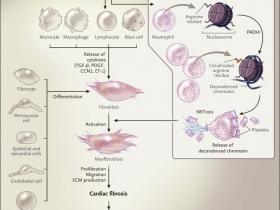
Los miofibroblastos son las células efectoras primarias en la remodelación tisular y la fibrosis. Se piensa que pueden originarse a partir de células mesenquimales y de pericitos (células contráctiles que envuelven la superficie externa de los capilares y vénulas). También se generan por medio de la transdiferenciación de células derivadas del epitelio y del epicardio (transición epitelial a mesenquimal), células endoteliales y de precursores derivados de la médula ósea (Figura 1).
Actualmente, se conocen ciertos factores desencadenantes de la fibrosis. La inflamación crónica activa miofibroblastos por medio de la regulación positiva de la citoquinas proinflamatorias, factores de crecimiento fibrogénicos y especies reactivas de oxígeno liberadas por una variedad de células invasoras, incluyendo las hematopoyéticas, epicárdicas, endoteliales y mieloides. Además, el envejecimiento se asocia con un aumento de la incidencia y gravedad de la fibrosis de órganos, la que parece estar causada, al menos en parte, por un desequilibrio entre las respuestas inmunes adaptativas innatas. Las señales inflamatorias orquestan la activación de los miofibroblastos locales para producir una excesiva matriz extracelular. Los miofibroblastos activados migran, proliferan, se diferencian y causan daño al tejido al liberar matriz extracelular y citoquinas, generando un bucle patogénico de retroalimentación positiva.
El reciente estudio de Martinod implica la participación de neutrófilos en la fibrosis cardíaca y pulmonar. Los neutrófilos activados forman trampas de neutrófilos (NETs) en un proceso denominado NETosis, que en general actúa como mecanismo de defensa antimicrobiano al inmovilizar y eliminar a los microorganismos invasores. Estas trampas están formadas por cromatina (un complejo ADN - proteína), que se libera de la célula moribunda - en este caso, el neutrófilo, aunque otros tipos celulares también pueden emplear la NETosis.
Los autores determinaron que la NETosis se activa durante el envejecimiento y tiene un papel en la fibrosis cardiopulmonar. Lo central en su trabajo fue la conclusión anterior de que la NETosis está mediada por la enzima peptidil arginina desaminasa tipo IV la cual añade un aminoácido (citrulina) a residuos específicos de arginina en los complejos histona - proteína alrededor de las que se enrolla el ADN. La citrulinación de histonas induce la descondensación de la cromatina, requerida para la liberación de NETs.
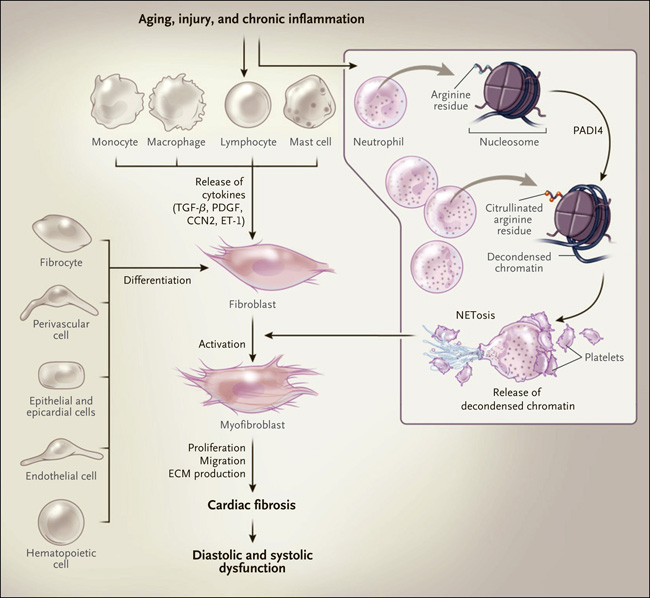
Figura 1: Modelo de la patogénesis molecular de la fibrosis cardíaca.
Los miofibroblastos se originan a partir de diversos tipos celulares y son activados por muchos actores celulares y moleculares, incluyendo las citoquinas como el factor de crecimiento transformante β (TGF-β), factor de crecimiento derivado de plaquetas (PDGF), el factor de crecimiento de tejido conectivo (CCN2) y endotelina 1 (ET-1). Los neutrófilos contribuyen a la activación de miofibroblastos mediante NETosis, en la que la enzima peptidil arginina desaminasa tipo IV (PADI4) añade citrulina a los residuos de arginina en las colas de las histonas, lo que permite la liberación de cromatina descondensada concomitante con la activación de complejos neutrófilos-plaquetas (inserción). Los miofibroblastos activados liberan proteínas de matriz extracelular (MEC) que contribuyen a la fibrosis y a insuficiencia cardíaca.
Martinod y colaboradores usaron ratones deficientes en la enzima PADI4 (padi4 - / -) para determinar la relevancia de esta enzima, y su rol en la NETosis y fibrosis tisular. Encontraron que los roedores padi4 - / - son resistentes a la fibrosis cardíaca inducida por la edad, lo que conduce a la prevención sistólica y diastólica. Asimismo, la incidencia de fibrosis pulmonar inducida por edad fue menor entre los ratones padi4 - / - que entre los ratones tipo silvestre (wildtype) lo que sugiere un papel general de esta vía enzimática en la fibrosis de órganos asociada a la edad. El efecto protector no solo se observó durante el envejecimiento sino que también cuando ratones control fueron sometidos a una sobrecarga de presión, lo que induce fibrosis. Debido a que PADI4 está altamente expresada en células inflamatorias y presenta niveles muy bajos en corazón y pulmón, los autores postulan que una reducción de la NETosis de neutrófilos probablemente subyace al fenotipo observado.
De hecho, aunque los recuentos de neutrófilos y plaquetas fueron elevados de manera similar en ratones control y padi4 - / -, este tipo celular en ratones tipo silvestre de edad avanzada fue promotor de la NETosis. Finalmente, en el modelo de sobrecarga de presión, el aumento de NETosis en presencia de PADI4 fue paralela a un mayor reclutamiento de neutrófilos y plaquetas al corazón, promoviendo la fibrosis mediante daño colateral inflamatorio y la entrega de TGF-β. Es plausible que un inhibidor de NETosis (por ejemplo, un inhibidor de PADI4) pudiera interferir con las respuestas reparativas de los neutrófilos, no sólo en el contexto de los principales daños agudos en los tejidos, como la miocarditis o lesiones pulmonares infecciosas, sino también en contexto de lesiones menores y continuas durante el envejecimiento.
Intrigantemente, la reciente identificación de monocitos atípicos con características de granulocitos, como progenitores críticos para la fibrosis, que en general no participan de los procesos proinflamatorios, destaca el potencial de desarrollo de nuevos fármacos antifibróticos que no comprometan la respuesta inflamatoria reparativa después de una lesión. Sin embargo, debido a que las respuestas a las lesiones tisulares varían dependiendo del tipo de lesión, el contexto de la enfermedad, y posiblemente entre especies, y dado que son procesos estrechamente controlados con respecto al momento de reclutamiento y retención de células invasoras, se necesitarán de estudios adicionales para descifrar los efectores inflamatorios y comprender su control temporal en el contexto de la enfermedad fibrótica en los seres humanos.
Fuente bibliográfica
Netting Insights into Fibrosis
Stefanie Dimmeler, Ph.D., and Andreas M. Zeiher, M.D.
Center of Molecular Medicine, University of Frankfurt.
DOI: 10.1056/NEJMcibr1616598
Temas Relacionados