La revolución genómica que viene
Nuevas tecnologías surgidas recientemente permiten la edición específica de los genomas en diversos sistemas (proceso que conlleva la corrección precisa de un defecto en un solo gen). Esto incluye la manipulación de las secuencias génicas en su contexto cromosómico natural y la movilidad de los transgenes a sitios específicos del genoma. Este progreso ha sido posible gracias a los avances en la ingeniería dirigida con nucleasas. Las mejoras recientes han podido optimizar el rendimiento de estas enzimas, acelerando su ensamblaje y reduciendo el costo de la edición del genoma. Tales avances están impulsando nuevos enfoques en muchas áreas de la biotecnología, incluyendo la producción biofarmacéutica, la agricultura, la creación de organismos transgénicos y de líneas celulares, y los estudios de la estructura, la regulación y función de los genes. La edición del genoma también se está investigando en terapias génicas preclínicas y clínicas para muchas enfermedades.
Edición y traducción en primates
La ingeniería genómica es atractiva, ambiciosa y multifacética. En el caso de aplicarse en los pacientes, se podría evaluar los riesgos de recibir un diagnóstico de cáncer o enfermedades del corazón. Los médicos detectarían rápidamente la base genética de una condición y tomar las medidas adecuadas para su tratamiento utilizando herramientas específicas “de edición del genoma". Yuyu Niu y colegas (Cell 2014; 156:836-843) y Hailiang Liu y colaboradores (Cell Stem Cell 2014; 14:323-328) han informado recientemente el uso de enzimas de restricción (llamadas endonucleasas) para introducir cambios concretos en el genoma de embriones de mono. Con la creación de estos animales transgénicos se ha establecido la primera prueba respecto a la edición dirigida de genes en las células madre totipotentes de primates.
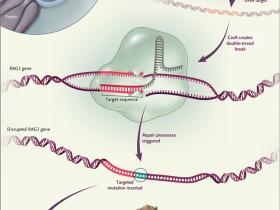
La edición genómica dirigida con endonucleasas es cada vez más popular; de hecho, se la ha reconocido como el "método o la revelación del año" en dos publicaciones en los últimos 3 años. Las endonucleasas son enzimas que cortan el ADN; al hacerlo, introducen una rotura en la doble cadena (figura 1 y figura 2). Pueden ser diseñadas de manera que corten el ADN en un sitio específico en el genoma celular en modelos orgánicos o seres humanos. La presencia de una rotura en la doble cadena activa los mecanismos celulares de reparación del ADN, que pueden aprovecharse para introducir cambios específicos, tales como la inserción de mutaciones dirigidas para destruir la función del gen - o, por el contrario, llevar a cabo la restauración de una secuencia mutada.
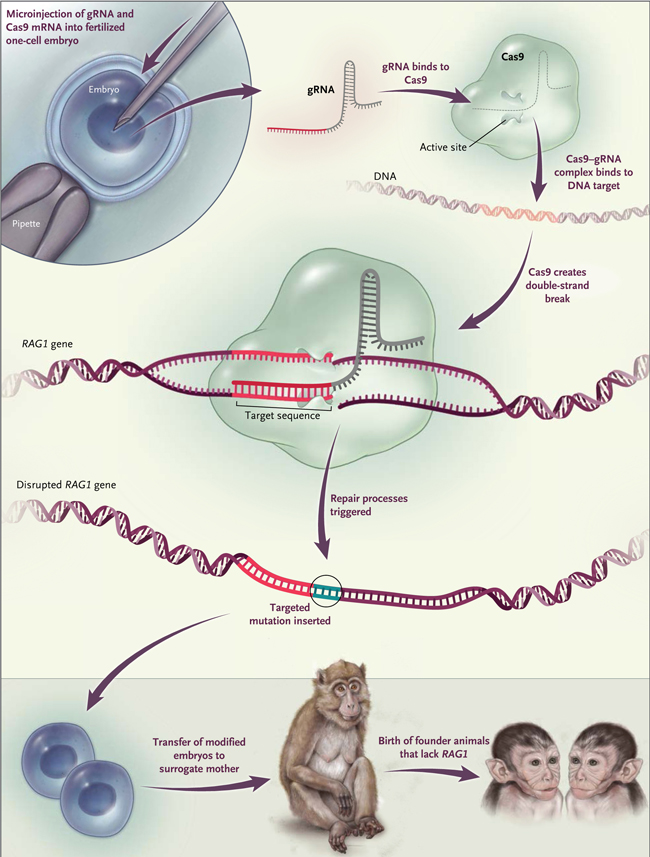
Figura 1: generación de macaco con edición de genes mediante el sistema CRISPR-Cas9
Las nucleasas guiadas por ARN se basan en el sistema CRISPR-Cas9 utilizado por los procariotas como una defensa contra la invasión de ADN. Se componen de un complejo formado por la enzima de escisión Cas9 y un ARN guía (gARN) que dirige la enzima a un sitio diana de 20 nucleótidos (rojo). El intercambio de una parte específica (rojo) de la molécula gRNA permitió a los investigadores reorientar la actividad de escisión de Cas9 a una secuencia diana definida. El procedimiento es el siguiente: el ARN mensajero (ARNm) que codifica la proteína Cas9 y la gARN es microinyectado en una célula de embriones. Después de la traducción de la proteína Cas9, el complejosCas9-gARN forma y escinde el gen diana. El ADN de doble filamento resultante activa los mecanismos de reparación del ADN celular, tales como la unión de extremos no homólogos, lo que se aprovecha para introducir una mutación dirigida con el fin de eliminar una función. Los cigotos genéticamente modificados son transferidos a otras hembras, que dan a luz a animales con la mutación deseada (RAG1-/-).
Las endonucleasas vienen en diferentes formas. Las meganucleasas y nucleasas de dedos de zinc se han utilizado desde hace bastante tiempo, y dos tipos se han desarrollado en los últimos años: nucleasas efectoras tipo activador de transcripción (TALEN) y nucleasas guiadas por ARN basadas en el sistema CRISPR (repeticiones palindrómicas cortas agrupadas regularmente)-Cas9. Una ventaja de las nuevas nucleasas es su versatilidad: pueden cortar en cualquier secuencia deseada del ADN.
Ambos estudios microinyectaron ácidos nucleicos codificantes de CRISPR-Cas9 o TALEN en embriones de monos para alterar los genes PPAR-γ y Rag1 o Mecp2, respectivamente. Los cigotos se transfirieron a hembras sustitutas, y los bebés nacidos después de los embarazos a término llevaban las mutaciones en los respectivos genes destinatarios. Como se ha observado en enfoques similares utilizados en otras especies, los animales fundadores tenían genotipos complejos, probablemente debido a que la edición de genoma no ocurre en el cigoto de una sola célula, pero sí más tarde, en la embriogénesis. Se debería realizar en el futuro, una caracterización más exhaustiva de las modificaciones del genoma en los diferentes tipos de células animales, así como la caracterización fenotípica de estos monos recién nacidos. Aun así, este es un avance relevante para la generación de modelos primates: su rápida regeneración es particularmente atractiva en la investigación de trastornos neuropsiquiátricos, porque el cerebro de ratón es un modelo fisiológico relativamente pobre para el cerebro humano. Pero, ¿cómo puede este enfoque desarrollarse aún más para el tratamiento de las patologías humanas?
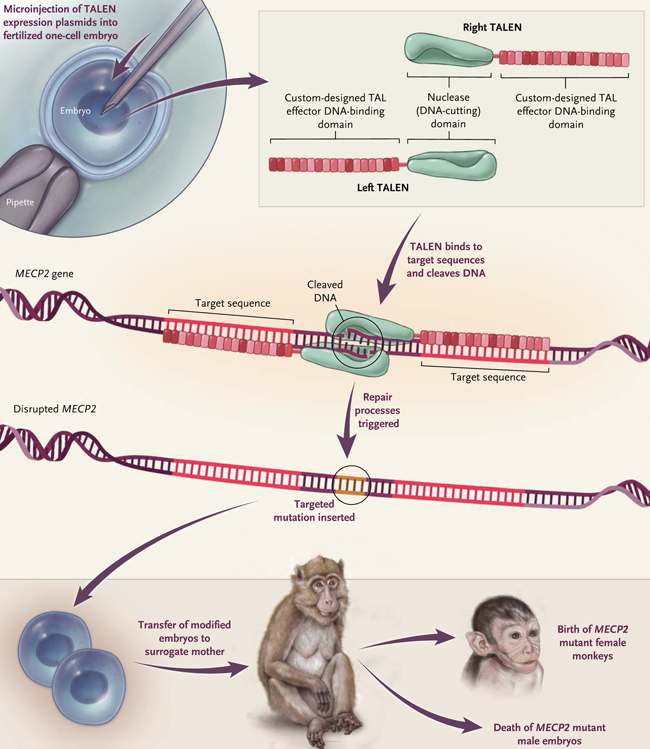
Figura 2: generación de macaco con edición de gens mediante TALEN
La técnica TALEN se basa en nucleasas naturales utilizadas por las bacterias patógenas de plantas para promover su replicación en las células huésped. Un monómero TALEN consiste en un dominio de clivaje de ADN derivado de la enzima de restricción FokI que se fusiona al dominio de unión TALEN del ADN que dirige la enzima a la subsitio objetivo (rojo). El procedimiento es el siguiente: los plásmidos de expresión que codifican a dos monómeros TALEN se microinyectan en un embrión fertilizado de una sola célula. Cada monómero se une a su respectivo subsitio de destino, permitiendo que los dos dominios de la nucleasa se dimericen y corten el ADN. El corte resultante conduce a la inserción de mutaciones en el sitio de escisión. Los embriones modificados genéticamente se transfieren a una madre sustituta, que da a luz a animales con la mutación deseada.
La interrupción de un gen es ciertamente más simple que la corrección de una o dos copias de genes disfuncionales, como es necesario en el caso de muchas enfermedades autosómicas recesivas. Por otra parte, la corrección de nucleótidos aberrantes requiere una plantilla, lo que plantea desafíos técnicos y biológicos adicionales. La inactivación de genes, tal como se aplica en los monos, se podría utilizar para tratar los trastornos causados por la ganancia de función heterocigota o por mutaciones dominantes-negativas (una mutación dominante-negativa resulta interfiere la proteína mutante con la función de la proteína no mutante). Enfermedades del sistema hematopoyético, como las inmunodeficiencias primarias causadas por el aumento de la función de las mutaciones en STAT1, que codifica la señal de transductor y activador de la transcripción de proteínas 1, es un ejemplo de este tipo de trastorno.
Aunque los estudios con CRISPR-Cas9 y TALEN se encuentran todavía en sus primeras etapas, se han hecho muchos avances importantes en la mejora de estas dos plataformas, incluyendo las modificaciones para optimizar la especificidad a la hora apuntar a un sitio específico del genoma. La escisión en off - eventos mutagénicos que conducen a un fenotipo maligno - es una preocupación importante, sobre todo si se produce en las células madre multipotentes destinadas a ser trasplantadas. Por lo tanto, la especificidad de las nucleasas será el factor clave de la terapia génica en la práctica clínica. La primera aplicación humana de las endonucleasas de diseño ha sido descrita recientemente. Nucleasas de dedos de zinc se utilizan para alterar el gen que codifica el correceptor CCR5 del virus de la inmunodeficiencia humana (VIH) en células autólogas CD4 T aisladas de las personas con infección por VIH, con el objetivo construir una resistencia celular al virus. El estudio demostró que la infusión de células T modificadas para CCR5 estaba a salvo, aunque la muestra fue pequeña (12 pacientes) y el seguimiento limitado (36 semanas); aún no se han reportado otras pruebas de seguridad que hayan implicado una muestra más amplia y con seguimiento a largo plazo.
Para mantener un efecto terapéutico duradero, se necesita que la edición del gen sea dirigida al ADN de las células madre. Las células madre somáticas postnatales, tales como células madre hematopoyéticas, son el tipo de unidad más accesible para la orientación, de hecho, se están diseñando protocolos cada vez más exitosos para la diferenciación de células madre pluripotentes inducidas, obteniendo un enfoque que implique la recolección de células somáticas, la inducción de la pluripotencia y la corrección de la mutación, seguido por la diferenciación y el trasplante.
La exitosa edición genética de embriones de primates unicelulares plantea cuestiones éticas que van más allá del equilibrio entre el valor científico de los modelos animales transgénicos en la comprensión de la enfermedad y las preocupaciones acerca de su creación humana. Estos estudios nos acercan a la posibilidad de manipular genéticamente embriones humanos. Con una actitud abierta y la voluntad de promover el debate ético, los científicos que desarrollan tecnologías de ADN de edición tienen la oportunidad de participar y enriquecer el discurso público, además de trabajar en el alivio del sufrimiento humano.
Fuente bibliográfica
Translating the Genomic Revolution — Targeted Genome Editing in Primates
Toni Cathomen, Ph.D., and Stephan Ehl, M.D.
Center for Chronic Immunodeficiency (T.C., S.E.), the Institute for Cell and Gene Therapy (T.C.), and the Department of Pediatrics and Adolescent Medicine (S.E.), University Medical Center Freiburg, Freiburg, Germany.
N Engl J Med 2014; 370:2342-2345