Epigenética y el futuro de la leucemia
Los cánceres sanguíneos frecuentemente son generados por translocaciones cromosómicas que originan proteínas de fusión causantes de enfermedades. Estas proteínas, que involucran al linaje de leucemia mixto (MLL) se encuentran comúnmente en leucemias agresivas pediátricas y se asocian con un mal pronóstico clínico. Por lo tanto existe una gran necesidad de desarrollar estrategias terapéuticas para leucemias que impliquen una reorganización de proteínas de fusión del MLL (MLL-r). Recientemente dos estudios convergen en la identificación de la proteína ENL como un factor crucial para la viabilidad de las células MLL-r en la leucemia. Además, proporcionan información relevante sobre la regulación transcripcional y destacan posibles vías para combatir esta agresiva patología.
Proteínas de fusión
Las histonas son proteínas estructurales y de señalización, alrededor de las cuales se envuelve el ADN celular. Su modificación por la adición o eliminación de grupos moleculares regula la expresión génica. Una característica estructural notable del factor de elongación transcripcional ENL es que posee un pliegue distintivo de aproximadamente 75 aminoácidos denominado dominio YEATS, que es un lector de acetilación: reconoce y se asocia con residuos del aminoácido lisina en las histonas que han sido modificadas mediante la adición de un grupo acetilo. Los investigadores proporcionaron evidencia convincente de que esta capacidad de "lectura" de ENL sobre las histonas acetiladas es crucial para la inducción de la leucemia MLL-r.
Los acompañantes del MLL se relacionan predominantemente con dos complejos de proteínas implicadas en la regulación epigenética, la modulación de la expresión génica independientemente de la secuencia de ADN. La primera es el súper complejo de elongación (SEC, por sus siglas en inglés), que facilita una fase de la transcripción llamada elongación. El segundo, es el complejo que contiene DOT1L (DotCom), que añade grupos metilo al residuo de lisina 79 en la histona H3 (abreviado comoH3K79). Las translocaciones que generan estas fusiones típicamente ocurren en uno de los dos conjuntos de cromosomas presentes en los mamíferos.
La opinión prevaleciente es que las proteínas de fusión MLLL promueven la localización de los complejos SEC y DotCom en regiones del genoma donde dirigen la expresión de genes que potencian el desarrollo de la leucemia. Los autores descubrieron otro mecanismo complementario de la estabilización de SEC y DotCom. Encontraron que la inactivación de ENL perjudicaba la función de ambos complejos en células MLL-r. La capacidad de ENL para asociarse físicamente con SEC y DotCom sugiere un modelo en el que la proteína -a través del reconocimiento de H3 acetilado por su dominio YEATS- coordina la estabilización y actividad de SEC y DotCom en regiones anormales del genoma (figura 1).
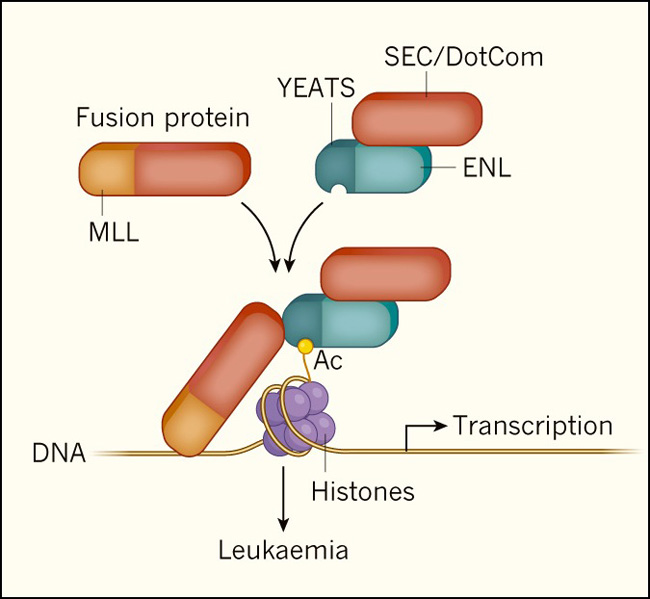
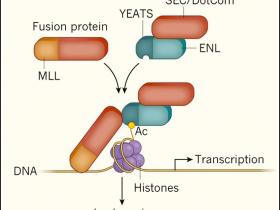
Figura 1: la proteína ENL es crucial para los rearreglos del MLL.
Algunas leucemias involucran la participación de proteínas híbridas anormales formadas por la fusión de una parte de la proteína del linaje de leucemia mixto (MLL) con una porción de una segunda proteína. Esta segunda proteína es a menudo parte del súper complejo de elongación (SEC) o del complejo que contiene a DOT1L (DotCom), los cuales modulan la expresión génica en leucemias donde ocurre un rearregle en el gen del linaje leucémico mixto (las proteínas enteras y fusionadas a SEC / DotCom se indican en rojo). La proteína ENL se asocia con ambos complejos, y, en las células en las que una copia del complejo se fusiona a MLL, interactúa con ambos complejos fusionados y no fusionados. ENL contiene un dominio YEATS que se une a grupos acetilados (Ac) específicos sobre la proteína histona H3. Los investigadores muestran que el dominio YEATS de ENL ayuda a estabilizar la asociación de SEC y DotCom con el ADN, promoviendo programas de expresión génica que favorecen la leucemia.
Este nuevo modelo plantea la posibilidad de que fármacos como los inhibidores de moléculas pequeñas, dirigidos al dominio YEATS de ENL, podrían eliminar selectivamente las células MLL-r leucémicas. Otros tipos celulares parecen ser altamente tolerantes a la pérdida de ENL, pero SEC, DotCom y ENL son ampliamente expresadas, por lo que será importante entender la base molecular de esta diferencia en la tolerancia a medida que estos fármacos se desarrollan.
El requisito para ENL en las leucemias MLL-r es consistente con las observaciones en las que la actividad DOT1L debidamente regulada es necesaria para el desarrollo y mantenimiento de las células MLL-r. La metilación H3K79 se ha vinculado desde hace tiempo y circunstancialmente, con genes transcripcionalmente activos y como mecanismos reguladores que rigen la actividad del DOT1L, surge una interrogante relacionada a cómo las señales codificadas por esta modificación de histonas influyen directamente en la transcripción.
Las señales de metil-lisina están típicamente conectadas a procesos descendentes por mecanismos análogos a los que participan en la lectura del dominio YEATS de las señales de acetil-lisina. Se han identificado dominios para los principales sitios de metilación de histonas aparte de H3K79. Además, las lisinas metiladas pueden ser reguladas dinámicamente por desmetilasas, pero aún no se ha logrado identificar alguna enzima que elimine el grupo metilo de H3K79. Los autores proporcionan aún más motivación para encontrar estos componentes, los que podrían predecir el punto de intersección con la señalización mediada por ENL bajo condiciones fisiológicas y patológicas.
Existe una apreciación emergente acerca de que los reguladores epigenéticos pueden tener un papel en la enfermedad. Este conocimiento ha acompañado los esfuerzos enfocados en desarrollar inhibidores dirigidos a estos procesos para tratar el cáncer. Recientemente, se ha evaluado un inhibidor de DOT1L en un ensayo para leucemias MLL-r. Intrigantemente, Michael A. Erb y sus colaboradores (Nature. 2017 Mar 9;543(7644):270-274) mostraron que el tratamiento de las células con inhibidores de DOT1L, en conjunto con un mutante de ENL incapaz de reconocer lisina acetilada, suprime la expresión del gen promotor de leucemia más eficientemente que la interrupción de la proteína sola, lo que sugiere una cooperación sinérgica entre estas intervenciones.
Liling Wan y sus colegas (Nature. 2017 Mar 9;543(7644):265-269) también investigaron el potencial de la terapia combinatoria para tratar la leucemia MLL-r, dirigida a los dominios de unión acetil-lisina y al bromodominio de la familia proteica BET. Las proteínas BET normalmente interactúan con SEC y promueven la elongación de la transcripcion. Los fármacos inhibidores de BET, interrumpen la unión de las proteínas BET a motivos de acetil-lisina, y actualmente existen alrededor de 20 ensayos clínicos que han probado la eficacia de estos para el tratamiento contra el cáncer. Los autores encontraron que la perturbación del dominio ENL YEATS combinado con el tratamiento con el inhibidor BET JQ1 fue altamente tóxico para las células leucémicas MLL-r.
Los efectos de estas intervenciones combinatorias resaltan cómo la integración de múltiples señales de histonas modificadas es útil en el establecimiento del estado epigenético distinto del estado leucémico. Como tales, estos cánceres pueden ser susceptibles a una orientación multidireccional que podría aumentar la eficacia terapéutica y mitigar el surgimiento de la resistencia a los fármacos, que es un riesgo con enfoques farmacológicos individuales.
Finalmente, existe un creciente interés - en parte debido al éxito de los inhibidores BET - en el uso de terapias que apuntan a diversos dominios lectores. El sitio de unión del dominio YEATS es atractivo para el desarrollo de fármacos, porque es propicio para el alojamiento de residuos acetil-lisina junto con modificaciones análogas mayores. De esta forma, el descubrimiento de que lecuemias MLL-r dependen de ENL no sólo provee información fundamental sobre cómo se integran señales relacionadas con la transcripción, sino que también tiene implicaciones para el tratamiento de una enfermedad compleja.
Fuente bibliográfica
Cancer epigenetics: Reading the future of leukaemia
Alex W. Wilkinson & Or Gozani
Department of Biology, Stanford University, Stanford, California 94305, USA.
doi:10.1038/nature21894
Temas Relacionados