Epigenética: al rescate de la inmunoterapia
Diversas investigaciones realizadas en ratones, han contribuido a elaborar un mecanismo basado en moduladores epigenéticos, capaces de potenciar la inmunoterapia contra el cáncer. Esto es logrado mediante la azacitidina, fármaco inhibidor de la ADN metiltranferasa, encargada de una de las modificaciones epigenéticas más relevantes para modular la expresión génica. El bloqueo de esta enzima, desencadena una serie de eventos intracelulares resultantes en una respuesta de tipo antiviral, mediada por interferón. Esta reacción inmunológica, reactiva a células encargadas de la citotoxicidad, como los linfocitos T, los que pueden eliminar células anómalas como las tumorales. La depleción de este tipo celular se consigue dado que mediante esta vía se facilita la exhibición de péptidos tumorales, que posteriormente son reconocidos por el receptor de células T. En última instancia, se obtiene una mejora en la capacidad de respuesta a la inmunoterapia, mediante un llamativo mecanismo de regulación epigenética, abriendo una gran oportunidad para optimizar el tratamiento de diversos tipos de cáncer.
Respuesta antiviral y cáncer
La reciente llegada de fármacos inhibidores de los puntos de control inmunológico, utilizados por primera vez para el melanoma y más recientemente probados como tratamiento para diferentes tumores sólidos y cánceres hematológicos, ha cambiado el enfoque terapéutico de estas patologías. Las tasas de respuesta han sido impresionantes, al igual que las mejoras en la supervivencia global, siendo en algunos casos, de varios años. Sin embargo, la falta de respuesta frente a un solo agente terapéutico y la aparición de resistencia, representan un considerable problema. Actualmente, han sido utilizadas varias estrategias combinadas, pero sus grados de éxito clínico han sido variables.
Por los motivos anteriormente expuestos, es que son muy bienvenidos y necesarios, nuevos enfoques experimentales, como los recientemente descritos por los equipos de Chiappinelli (Cell. 2015 Aug 27;162(5):974-86) y de Roulois (Cell. 2015 Aug 27;162(5):961-73). Estos investigadores identificaron un mecanismo de acción inmunológica, basado en una determinada clase de moduladores epigenéticos, como los inhibidores de ADN metiltransferasa, actualmente utilizados para tratar cánceres hematológicos. Este trabajo, por ende apunta a una combinación de nuevos agentes inmunoterapéuticos y moduladores epigenéticos que controlan puntos de chequeo claves de la respuesta inmunológica.
Chiappinelli y sus colegas, reportaron previamente que el tratamiento de células cancerígenas con un inhibidor de la ADN metiltransferasa, azacitidina, sobre regula la expresión de genes de las vías inmunorreguladoras, especialmente aquellos que modulan la señalización de interferón. En su estudio más reciente, identificaron un curioso mecanismo, que subyace una respuesta inmune mediada por azacitidina mostrando que la exposición a este fármaco sensibiliza a las células de melanoma frente a la terapia de inhibidores de puntos de control inmunológicos, en un modelo preclínico de la patología.
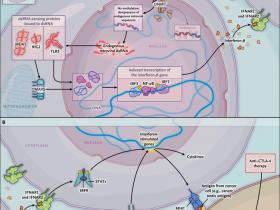
El mecanismo descrito por los autores, involucra la detección ARN de cadena doble (dsRNA, por sus siglas en inglés) presente en el citoplasma, a través de las proteínas TLR3, MDA5, y RIG1. La expresión de estas proteínas en varios tipos de células se encuentra sobre regulada en respuesta a la infección viral, gatillando la respuesta interferón tipo I. Los autores plantearon la hipótesis de que la activación mediada por azacitidina (descrita con más precisión como desrepresión) de secuencias retrovirales endógenas, usualmente silenciadas epigenéticamente por la metilación del promotor del gen, activan la vía de detección de dsRNA y la respuesta de interferón I (fig. 1). La inducción de la expresión de varias secuencias retrovirales endógenas, mediada por el medicamento, se correlacionó temporalmente con la expresión de genes de defensa viral (y no las proteínas), lo que apoya esta hipótesis (fig. 1). Estudios de expresión génica in vivo de cáncer ovárico endotelial primario, mostraron subsecuentemente, que los altos niveles de expresión de tales secuencias, se correlacionan con altos niveles de expresión de genes anti-virales.
Luego, los autores evaluaron los niveles de inducción de estos mismos genes en casos de melanoma y cáncer de ovario, mama, colon y pulmón. Los tumores se clasificaron en grupos con niveles bajos y altos de expresión y se evidenció que los segundos eran más propensos a estar relacionados con buenos pronósticos clínicos. Esto planteó la siguiente interrogante: ¿Existe una asociación entre la activación de la vía anti-viral y la respuesta a la terapia de puntos de chequeo inmunológico? La respuesta parece ser afirmativa. Los investigadores encontraron elevados grados de expresión de estos genes, en tumores de pacientes que recibieron y se beneficiaron del tratamiento a largo plazo, con la proteína 4 anticitotóxica asociada a linfocitos T (CTLA-4) y por otro lado, hallaron menores niveles de expresión en tumores de individuos que no obtuvieron beneficios con la terapia. Los investigadores, no obstante, no reportaron un análisis de pacientes que no recibieron terapia anti-CTLA-4.
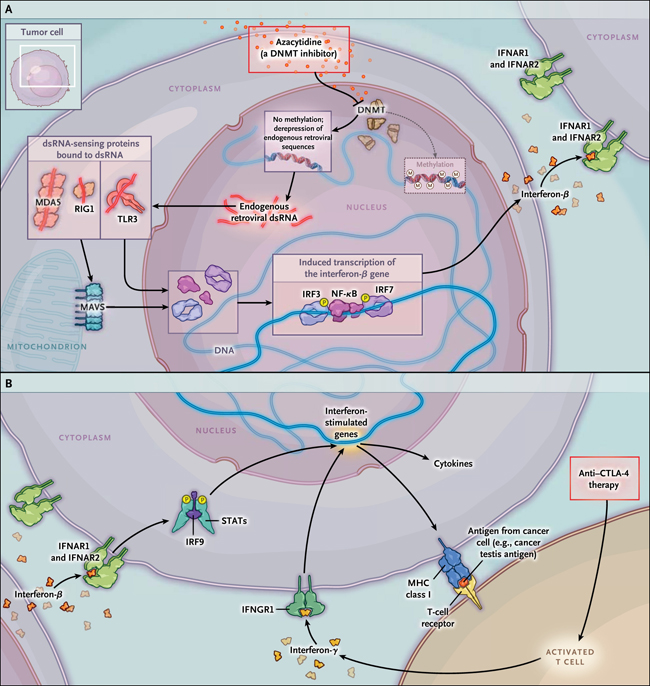
Figura 1. Aumento de la "visibilidad" de células tumorales para el sistema inmunológico, mediante el uso de una imitación viral.
Chiappinelli, Roulois y sus respectivos equipos, reportaron recientemente que la desrepresión de las secuencias retrovirales endógenos (ERVS, por sus siglas en inglés) inducida por fármacos, pone en marcha una cadena de eventos que resultan en la síntesis y secreción de interferón-β. Las ERV transcritas son reconocidas por proteínas de detección de ARN de doble hebra (dsRNA) - (MDA5, RIG 1 y TLR3). Estas proteínas, ya sea directa o indirectamente (a través de la proteína de señalización antiviral mitocondrial [MAVS]) sobre regulan la expresión de interferón mediante la translocación hacia el núcleo del factor regulador de interferón (IRF) 3, el factor nuclear kappa B (NF-kB) y de IRF7, promoviendo la transcripción de IFNB1 (panel A). El interferón-β a su vez estimula los receptores de interferón α / ß 1 y 2 (IFNAR1 y IFNAR2), activando a IRF9 y a transductores de señales y activadores de transcripción (STAT), resultando en una respuesta antiviral mediada por citoquinas (panel B). La sobre regulación de citoquinas antivirales y la comunicación cruzada entre IFNAR1, IFNAR2 y el receptor de interferón-γ (IFNGR1) resulta en la expresión de péptidos en la superficie celular (por ejemplo, antígenos de cáncer de testículo), a través del complejo mayor de histocompatibilidad clase I (MHCI) y en la activación de la inmunidad mediada por el receptor de células T. Chiappinelli y colegas, también mostraron pruebas que apoyan la hipótesis de que la desrepresión de ERVS inducida por fármacos, sensibiliza a células cancerosas frente a la terapia anti-CTLA-4. DNMT, denota ADN metiltransferasa, M metilación, y P fosforilación.
Por último, se evaluó el efecto del tratamiento con azacitidina en un modelo de melanoma en ratones. El fármaco mejoró la capacidad de respuesta de los tumores a la terapia anti-CTLA-4, mientras que el pretratamiento de células del melanoma antes de la inyección del medicamento resultó en una completa eliminación de estas células en ratones que recibieron anti-CTLA-4. Una importante línea de investigación sería "cerrar el círculo", es decir, demostrar que la respuesta terapéutica es impulsada por los linfocitos que se unen específicamente a antígenos presentes en las células tumorales, las que exhiben altos niveles de expresión de genes virales de defensa.
Roulois y colaboradores también describieron la presencia de un sistema de detección basado en ARN de cadena doble, en células de cáncer de colon, con componentes moleculares similares a los anteriormente descritos, los que dan lugar a la sobre regulación de secuencias retrovirales mediado por inhibidores de ADN metiltransferasas. También observaron que la regulación de este sistema está asociado con la el aumento de la respuesta a interferón, lo que fue catalogado como un "mimetismo viral", respuesta a la que atribuyen los efectos antitumorales de los inhibidores de la enzima metilasa.
En conjunto, estas observaciones proporcionan una explicación mecanicista de la modulación epigenética de la respuesta inmune, evidenciada en estudios previos. Esto apunta a la tentadora posibilidad de que el tratamiento de múltiples tipos de tumores puedan ser mejorados combinando agentes epigenéticos o "sensibilizadores inmunológicos", tales como los inhibidores de la ADN metiltransferasa, junto a bloqueadores de CTLA-4. Otra importante línea de investigación será evaluar la expresión de genes antivirales en tumores, como base para la selección de estrategias de tratamiento. Finalmente, futuros ensayos clínicos de fase temprana, que combinen inhibidores de la enzima e inhibidores de punto de controles inmunológicos, pueden ser de gran ayuda para tratar estas patologías.
Fuente bibliográfica
Epigenetic Modulators and the New Immunotherapies
Anthony E. Dear, M.B., B.S., Ph.D.
Eastern Clinical Research Unit, Translational Research Division, Department of Medicine, Eastern Health Clinical School, Monash University, Melbourne, VIC, Australia.
DOI: 10.1056/NEJMcibr1514673