Edición genómica para trasplantar órganos
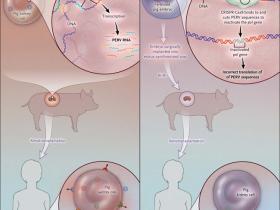
Recientes estudios han implementado una novedosa técnica molecular, conocida como CRISPR – Cas9. Este sistema, se basa en regiones de ADN con repeticiones cortas de bases nitrogenadas, separadas mediante secuencias espaciadoras originadas a partir de ADN viral (o de otro tipo) insertado en el genoma celular. Estos elementos fueron originalmente descubiertos en procariontes y corresponden a un tipo de inmunidad que les permite degradar material genético externo, como el de bacteriófagos o plásmidos de patógenos invasores. En bacterias, las regiones espaciadoras de los CRISPR, reconocen secuencias específicas y guían a enzimas (nucleasas Cas 9) que degradan este ADN foráneo, de una forma análoga al sistema de ARN interferente en eucariontes. Una reciente aplicación de esta técnica, permitió degradar regiones del genoma de retrovirus endógeno porcino, integrado en el ADN de células renales del animal. Dada la alta demanda de trasplantes a nivel mundial, el xenotrasplante de riñón porcino hacia humanos, representa una alternativa vital para los millones de afectados, sin embargo el riesgo de transmisión de enfermedades infecciosas es un enorme reto terapéutico. Afortunadamente, para solucionar este problema, mediante el enfoque molecular CRISPR – Cas9, se ha logrado inactivar una serie de retrovirus porcinos, mediante la degradación de sus genes virales, lo que a futuro permitirá obtener órganos libres de riesgo infeccioso para el xenotrasplante.
Inactivación de genes virales
El trasplante es una terapia salvadora de vidas en casos de insuficiencia de órganos en fase terminal (en el riñón, hígado, corazón, y enfermedad pulmonar). Sin embargo, esto no siempre fue así. El éxito de la investigación básica, traslacional y clínica, ha creado otro reto que es tan desconcertante como trágico: la escasez de donantes de órganos. Actualmente existen más de 120.000 pacientes en Estados Unidos en lista de espera de la United Network for Organ Sharing. Las personas esperan, en promedio, entre 4 y 6 años para someterse a la intervención, si es que no mueren durante ese tiempo: aproximadamente 22 pacientes en espera mueren diariamente, y muchos se vuelven inactivos (es decir, se convierten temporalmente en no elegibles para el tratamiento) o quedan fuera de la lista por razones médicas. Además, en conjunto, las listas adquieren un nuevo paciente, aproximadamente cada 10 minutos, lo equivalente a 50.000 individuos cada año y a futuro sólo habrá una capacidad total de realizar 23.000 trasplantes anuales.
Esta dura realidad, ha impulsado la investigación en xenotrasplantes, lo que implica el desarrollo de órganos de animales para el trasplante en humanos. Aunque muchos animales (desde primates no homínidos hasta los peces) se han estudiado para este propósito, el más pragmático es el cerdo, debido a que es domesticado y criado en ambientes libres de patógenos y porque el uso de este animal es relativamente aceptable.
Actualmente, hay dos desafíos médicos primarios que deben ser exitosamente abordados por los xenotrasplantes para convertirse en una práctica común: el rechazo inmunitario a los tejidos animales y el riesgo de transmisión de enfermedades infecciosas. Bajo estrés, las células del cerdo liberan retrovirus endógenos porcinos (PERV, por sus siglas en inglés), que son capaces de infectar a células humanas. No existen casos de humanos infectados, sin embargo muy pocos pacientes xenotrasplantados han sobrevivido lo suficiente como para ser evaluado en este aspecto. Además, desde que el virus fue identificado por primera vez en 1995, se han realizado escasos estudiuos para abordar con eficacia el problema del riesgo de infección.
El reciente estudio realizado por Luhan Yang y colegas es relevante para ambos desafíos. Utilizando el sistema denominado CRISPR (repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas) - Cas9, que se dirige una secuencia de ADN específica para su interrupción, los investigadores lograron mediante ingeniería genética, una inactivación en un solo paso, de más de 60 copias de PERV, reduciendo así el riesgo infeccioso en tres órdenes de magnitud (fig. 1). Los autores, identificaron una secuencia en el gen retroviral pol (uno de los tres genes que componen los retrovirus endógenos) que está presente en los PERV. Este gen, codifica para la transcriptasa inversa (enzima utilizada para transcribir ADN viral en ARN), y su disrupción inactiva la producción de particulas virales y una potencial infección. Utilizando el sistema CRISPR - Cas9 para interrumpir el gen pol en una línea celular de riñón de cerdo, además demostraron la exitosa inactivación 62 inserciones de PERV activos y observaron una reducción sustantiva en los niveles de infección de cultivos de células de riñón embrionario (humano) por parte del retrovirus. Estos hallazgos muestran la capacidad de la técnica molecular para inactivar múltiples genes en una célula, resultado que tiene implicancias en el tratamiento de enfermedades genéticas complejas (por ejemplo, el cáncer). Esta obra de ingeniería genética también tiene relevancia para el desafío de un xenotrasplante: el riesgo de rechazo de órganos provocada por una respuesta inmune a "xenoantígenos."
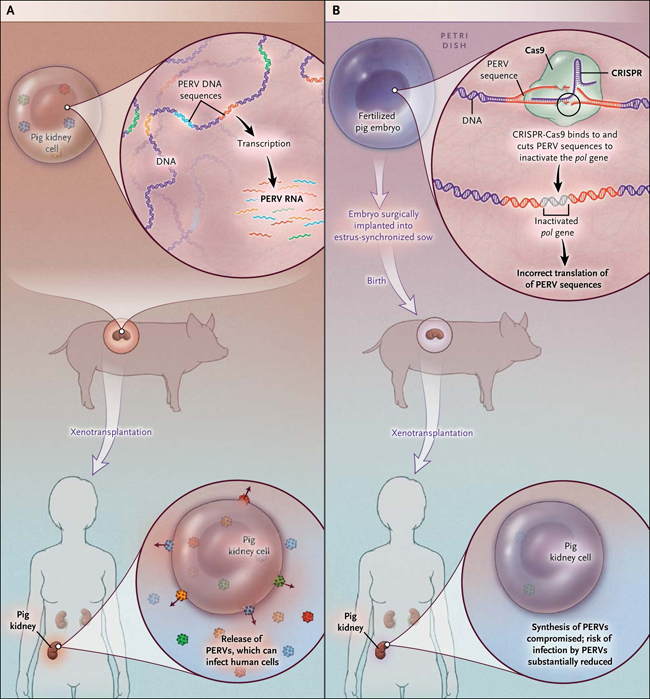
Figura 1. Ingeniería Genética y xenotrasplantes.
Los retrovirus endógenos porcinos (PERV) pueden infectar células humanas y por lo tanto representan un riesgo relacionado a los xenotrasplantes (panel A). Yang y sus colegas utilizaron el método CRISPR (repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas) - Cas9 para inactivar 62 secuencias de PERV incrustadas en el genoma porcino. Con la aplicación de la técnica, observaron una reducción dramática en la producción estas secuencias retrovirales. En teoria, este método podría ser utilizado para diseñar cerdos genéticamente modificados suprimiendo la producción de PERV (panel B).
Por supuesto, que aún existen mayores obstáculos para implementar tal modificación genética para obtener beneficios clínicos. Los mecanismos moleculares que subyacen al rechazo de tejidos de cerdo son poco conocidos, por lo que es difícil diseñar con confianza una estrategia para prevenir este problema. La determinación de la mejor forma de entrega del sistema CRISPR - Cas9 hacia un determinado tipo celular también supone un desafío. Incluso con un buen acceso a la diana celular (una línea celular), Yang y colegas reportaron una eficacia global de la inactivación génica que oscila desde un 20 a un 30%. Además, fue necesario un procedimiento para purificar las células con los más altos niveles de inactivación de pol. Por último, siguen habiendo serias preocupaciones acerca de los efectos fuera de objetivo (por ejemplo, la inactivación inadvertida de otros genes), en particular en el contexto de animales modificados genéticamente. Sin embargo, la tecnología CRISPR - Cas9 continúa desarrollando rápidamente nuevos protocolos que prometen niveles mucho más altos de especificidad de genes.
En resumen, a pesar del creciente entusiasmo sobre el aprovechamiento de la técnica para evaluar su efecto terapéutico, todavía hay una gran cantidad de trabajo por realizar, no sólo en el diseño de una estrategia de entrega eficiente y específico, sino que también en profundizar en el conocimiento de los mecanismos de enfermedades (es decir, qué genes, qué variantes de splicing y sus niveles, qué organos y tipos celulares están involucrados en un proceso patogénico determinado). La ingeniería genética posee poco valor sin un alto nivel de confianza en el conocimiento de los mecanismos de la enfermedad subyacente. Además, muchas patologías no tienen un componente genético evidente, aunque genes específicos pueden influir en mayor medida. Aún es incierto cómo todos estos retos pueden afectar a la terapia mediada por CRISPR - Cas9. Sin embargo, es importante reconocer que la inactivación de 60 diferentes copias de genes de la polimerasa de PERV, en una única célula, puede conducir a la producción de una clase de estos animales para xenotrasplantes, con un menor riesgo de transmisión de PERV a pacientes inmunosuprimidos.
Finalmente, estos avances conducen hacia una reflexión: CRISPR - Cas9 fue descubierto originalmente como un mediador de la inmunidad innata bacteriana (contra fagos o infecciones por otros agentes). Por lo tanto, esto representa un excelente ejemplo acerca de cómo la investigación científica más básica puede transformarse rápida e inesperadamente en progresos médicos.
Fuente bibliográfica
A CRISPR Way to Block PERVs — Engineering Organs for Transplantation
Daniel R. Salomon, M.D.
Department of Molecular and Experimental Medicine, Scripps Research Institute, San Diego, CA.
DOI: 10.1056/NEJMcibr1515623