Diabetes y nefroprotección en la enfermedad renal
Los riñones en personas normoglucémicas filtran entre 160-180 gramos de glucosa por día (~ 30% de la ingesta diaria de calorías), cantidad que puede regresar a la circulación sistémica por el túbulo proximal. Sin embargo, la hiperglucemia aumenta la glucosa filtrada y reabsorbida hasta dos o tres veces. Uno de los factores implicados en este evento fisiológico es el cotransportador sodio glucosa (SGLT2), proteína que representa la principal vía para la reabsorción renal de glucosa. La inhibición de SGLT2 aumenta la glucosa urinaria y la pérdida de calorías, reduciendo así sus niveles plasmáticos y el peso corporal. Los primeros inhibidores de SGLT2 han sido aprobados como una nueva clase de fármacos contra la diabetes mellitus tipo 2, y se están realizando estudios para investigar su uso en la condición de tipo 1. Estos compuestos funcionan independientemente de la insulina, mejoran el control glucémico en todas las etapas de la patología en ausencia de hipoglucemia clínicamente relevante y pueden combinarse con otros agentes antidiabéticos. Debido a que son capaces de reducir la presión arterial y la hiperfiltración glomerular diabética, los bloqueadores de SGLT2 pueden inducir importantes efectos protectores en el riñón y en el sistema cardiovascular.
La enfermedad renal es un determinante crítico de mortalidad por causas cardiovasculares en personas con diabetes mellitus. Más allá de los medicamentos que controlan la glucemia y la presión arterial, solo los medicamentos que inhiben el sistema renina-angiotensina (RAS) han tenido fuertes efectos renoprotectores en estudios aleatorizados y controlados. Un estudio recientemente publicado (ensayo EMPA-REG OUTCOME) mostró los efectos renoprotectores de la empagliflozina, un inhibidor del cotransportador sodio-glucosa 2(SGLT2) en la diabetes tipo 2. Sin embargo, esto lleva a la siguiente pregunta: ¿Cómo y por qué un inhibidor de SGLT2 es protector de los riñones?
Las unidades de trabajo del riñón son los nefrones. Cada una de estas células está formada por un glomérulo que filtra el fluido de la sangre, y un tubulo renal, que modifica el filtrado a través de la resorción de agua y algunos solutos y por medio de la secreción de otros. La concentración del producto final, la orina, depende de la hidratación, excreción de soluto, carga osmótica y otros factores. En los seres humanos, el número total de nefronas se establece al nacer y disminuye con el tiempo como resultado de lesiones y el envejecimiento. La función excretora del riñón es comúnmente expresada como la tasa de filtración glomerular (TFG), una medida dinámica que depende del funcionamiento de un solo nefrona (la TFG de una sola de estas células) y el número total de nefronas.
Una TFG normal se mantiene en un rango submáximo con una reserva renal funcional que puede aumentar para acomodar el volumen transitorio o la osmolaridad. Cualquier tipo de pérdida de nefronas resulta en un incremento en la TFG de un solo nefrón para para mantener una TFG total normal. Una vez que la pérdida de nefronas es tan grande que no se puede mantener una TFG normal (evento observado en pacientes con estadio 3, 4 o 5 de enfermedad renal crónica), la TFG de un solo nefrón se incrementa persistentemente, a menudo (pero no siempre) como resultado de un aumento de la presión de filtración entre la barrera de filtración en el glomérulo. Este efecto se asocia con el estrés y la pérdida de podocitos. La tasa de pérdida de podocitos en pacientes que no tienen enfermedad renal es de aproximadamente un podócito por año por glomérulo, y esa tasa aumenta drásticamente en presencia de una alta presión de filtrado, debilidad podocítica genética, o en casos de daños metabólicos, genéticos o inmunológicos. A cierto umbral, la pérdida de podocitos conduce a una glomerulosclerosis y luego a la atrofia de todo el nefrón.
La presión de filtración es constante a lo largo de los niveles de presión sanguínea debido a la respuesta vascular miogénica, que consiste en la contracción del músculo liso vascular provocada por la activación de canales iónicos sensibles al estiramiento presentes en la membrana de células de la musculatura lisa. La respuesta vascular miogénica interactúa con la retroalimentación tubuloglomerular, un mecanismo que regula la TFG a través de la mácula densa, que detecta la concentración de cloruro de sodio (NaCl) en el fluido tubular. La macula densa transduce un aumento en la concentración de cloruro de sodio en el fluido tubular en una la liberación de adenosina y en un aumento de la actividad renina en el aparato yuxtaglomerular, efecto que puede deberse a la activación directa o a una disminución de la liberación de renina mediada por adenosina. La estimulación del feedback tubuloglomerular conduce a la vasoconstricción de la arteriola aferente y a una disminución en la TFG de una nefrona individual. La disminución de la concentración de NaCl en el líquido tubular en la mácula densa tiene los efectos inversos.
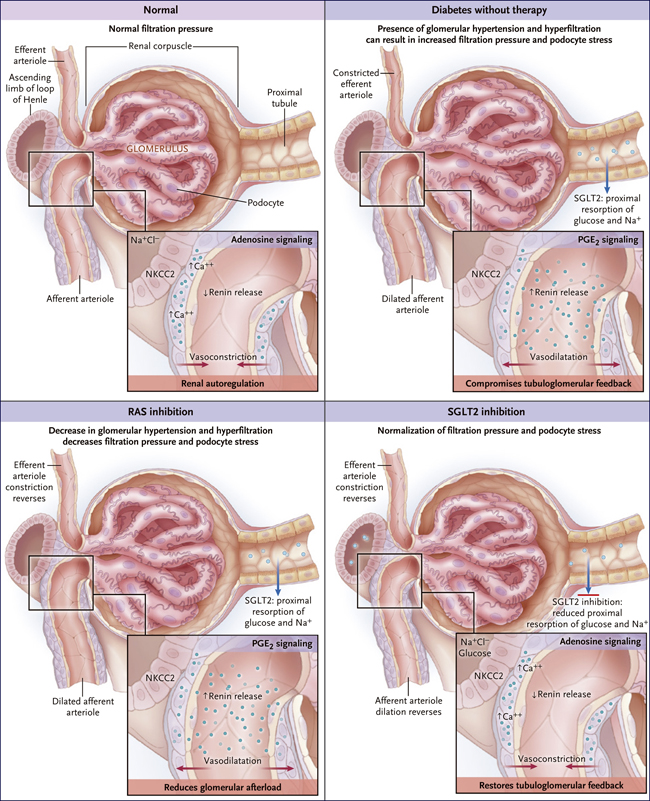
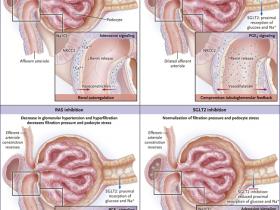
Figura 1: presión de filtración glomerular que impulsa albuminuria, pérdida de podócitos y glomeruloesclerosis en la diabetes.
La diabetes inicia el compromiso de la retroalimentación tubuloglomerular impulsado por el cotransportador de sodio-glucosa 2 (SGLT2). Este proceso dilata directamente la arteriola aferente e induce indirectamente la vasoconstricción de la arteriola eferente. El resultado es un aumento en la presión de filtración y de la tasa de filtración glomerular (TFG). La inhibición del sistema renina-angiotensina (RAS) corrige el aumento de la post-carga glomerular pero no la dilatación de la arteriola aferente. Este problema sólo puede corregirse mediante la inhibición de SGLT2, que restaura la retroalimentación tubuloglomerular. Tanto la inhibición de SGLT2 como la inhibición de RAS reducen la presión de filtración glomerular, lo que se traduce en efectos protectores a largo plazo. NKCC2 cotransportador de sodio-potasio-cloruro 2 y PGE2, prostaglandina E2.
La protección renal que se consigue con inhibidores del sistema RAS se relaciona con la vasodilatación de arteriolas. Dado que la vasodilatación de la arteriola eferente es mayor que la vasodilatación de la aferentes, la post-carga glomerular y la presión de filtrado son sustancialmente menores, especialmente si la hiperfiltración glomerular y la hipertensión están presentes (figura 1). Debido a que el RAS está altamente activado en casi todas las formas de enfermedad renal crónica, sus inhibidores tienen efectos protectores de nefrones no sólo en pacientes diabéticos sino también en casos de enfermedades renales no diabéticas. De hecho, la rigurosa inhibición de RAS puede incluso inducir la regresión de la enfermedad renal no diabética, un resultado que no es alcanzable en pacientes que si presentan diabetes. El motivo aun sigue sin comprenderse.
El riñón en un paciente diabético con enfermedad renal difiere del riñón de un paciente con enfermedad renal no diabética porque la hiperglucemia inhibe de forma persistente el efecto vasoactivo directo de la retroalimentación tubuloglomerular (Figura 1). Este fenómeno era difícil de evidenciar específicamente hasta que se encontraron inhibidores de SGLT2. Esta proteína es expresada selectivamente en el túbulo proximal y facilita la recaptación de glucosa y sodio filtrados, en una relación 1: 1, y este proceso se estimula al máximo por la filtración masiva de glucosa en la hiperglucemia. Como resultado, la hiperglucemia disminuye drásticamente la concentración de sodio a la que está expuesta la mácula densa y por lo tanto inhibe persistentemente la retroalimentación tubuloglomerular, dilata la arteriola aferente e induce hiperfiltración glomerular en muchos pacientes (Figura 1).
La inhibición de la retroalimentación tubuloglomerular en la diabetes, expone persistentemente a la delicada barrera de filtración glomerular a una mayor presión de filtración, la que en un paciente con hipertensión intraglomerular, promueve barotrauma de podocitos y acelera la pérdida de estas células y de nefronas. Sin embargo, los inhibidores de SGLT2 son capaces de terminar la masivo reabsorción de glucosa y sodio dirigida por SGLT2 en los túbulos proximales y por lo tanto aumentar el la concentración de NaCl en la mácula densa. Este cambio estimula la retroalimentación tubuloglomerular, lo que normaliza la presión de filtración, atenúa la pérdida de podocitos y nefronas (Figura 1) y restaura la TFG submáxima. En ciertos pacientes, algunos inhibidores de SGLT2 pueden bajar la TFG de forma aguda y masiva, incluso en la medida de causar insuficiencia renal aguda. La restauración de la TFG submáxima por medio de la inhibición de SGLT2 o de RAS es seguido de una estabilización a largo plazo de la TFG, que es un verdadero efecto protector del nefrón. De hecho, el fracaso las fallas renales son como corazones que fallan: duran más tiempo cuando están protegidos contra la sobrecarga funcional.
Cincuenta años después de que se identificó la retroalimentación tubuloglomerular, ahora parece que la inhibición de SGLT2 puede corregir su desactivación que se produce en la diabetes, una hazaña que, en combinación con la inhibición de RAS, tiene efectos nefro protectores. Sin embargo, en pacientes con hiperglucemia, los efectos de la combinación de ambos enfoques en el RAS intrarenal siguen sin ser dilucidados completamente. En adición, la inhibición de SGLT2 tiene numerosos mecanismos de acción que contribuyen a efectos secundarios beneficiosos en la diabetes. Por ejemplo, la inhibición de SGLT2 bloquea la gluconeogénesis renal, lo que provoca un efecto antidiabético moderado. Finalmente, la inhibición de SGLT2 induce una diuresis osmótica, que afecta favorablemente al peso, presión arterial, insuficiencia cardíaca, entre otros parámetros cardiovasculares.
Fuente bibliográfica
Nephron Protection in Diabetic Kidney Disease
Hans‑Joachim Anders, M.D., John M. Davis, Ph.D., and Klaus Thurau, M.D.
Department of Physiology, Ludwig-Maximilians- Universität München, Munich, Germany.
DOI: 10.1056/NEJMcibr1608564